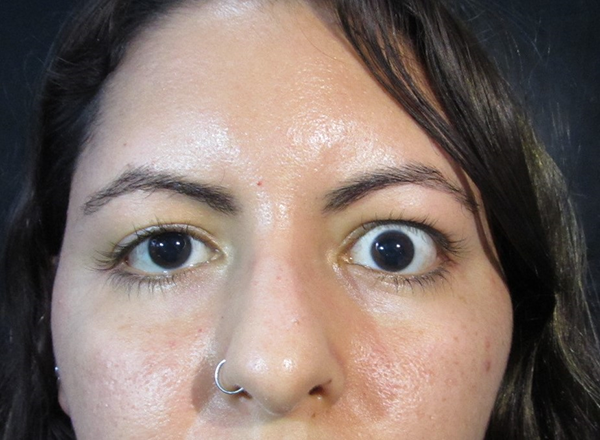
Figura 1. Retracción palpebral superior. Manifestación clínica más frecuente.
Enfermedad ocular tiroidea
Victoria Ariasgago, Milagros Aguilar, Daniel Weil
Sección de Oculoplastia, Hospital de Clínicas José de San Martín, Universidad de Buenos Aires, Argentina.
Recibido: 11 de abril de 2021.
Aprobado: 10 de junio de 2021.
Dra. Victoria Ariasgago
vikyari75@gmail.com
Oftalmol Clin Exp (ISSN 1851-2658)
2021; 14(3): 120-136.
RESUMEN
La enfermedad ocular tiroidea es una anomalía de origen autoinmune, más frecuente en las mujeres hipertiroideas de edad media, que se caracteriza por inflamación orbitaria debido a infiltración de linfocitos y plasmocitos con mucopolisacáridos que causan expansión y fibrosis de los músculos extraoculares y del tejido graso. Estos cambios orbitarios se pueden presentar previa, junto o posteriormente a la disfunción tiroidea, aunque la importancia de lograr el estado eutiroideo es esencial en su evolución. Existen factores de riesgo que empeoran la enfermedad, siendo central el cese del tabaquismo para un buen manejo en el tratamiento. La enfermedad se presenta en dos períodos: la etapa activa o inflamatoria y la etapa inactiva o secuelar. En la etapa activa de la enfermedad, con duración entre 6 a 18/24 meses, las manifestaciones clínicas son muy variadas: desde episodios leves hasta cuadros severos que incluso pueden comprometer la visión, por lo que reconocer las complicaciones de esta etapa es primordial para preservarla. Existen muchas clasificaciones y guías de diagnóstico y tratamiento basados en la desinflamación de la órbita para evitar secuelas incapacitantes, donde la corticoterapia es su eje, aunque en la actualidad existen muchas alternativas con fármacos inmunomoduladores que parecen ser muy prometedoras. En la etapa inactiva de la enfermedad, caracterizada por las secuelas de la etapa inflamatoria, se puede realizar una secuencia de cirugías destinadas a mejorar la calidad de vida de estos pacientes como así también controlar su aspecto estético. Es prioritario realizar imágenes tanto en la etapa activa, que orienten sobre qué estructuras orbitarias están afectadas, como en la etapa secuelar para evaluar el plan quirúrgico. En esta actualización revisaremos todos los aspectos de esta enfermedad, las guías de diagnóstico y tratamiento y presentamos un algoritmo de tratamiento para su mejor entendimiento.
Palabras clave: oftalmopatía de Graves, enfermedad ocular tiroidea, oftalmopatía distiroidea, orbitopatía distiroidea, oftalmopatía endocrina.
Thyroid eye disease
ABSTRACT
Thyroid eye disease is a condition of autoimmune origin, more common in middle-aged hyperthyroid women, and characterized by orbit inflammation due to lymphocytic and plasmocytic infiltration with mucopolysaccharides causing expansion and fibrosis of extraocular muscles and fat tissue. Though these changes in the orbit may appear before, simultaneously with or after thyroid dysfunction occurs, the importance of achieving an euthyroid state is essential for their evolution. There are risk factors worsening the condition, with smoking cessation as the core for good management during therapy. The disease has two periods: the active or inflammatory phase and the inactive or burnt out phase. During the active phase of the disease, having a duration between 6 and 18/24 months, clinical manifestations vary widely: from mild episodes to severe pictures that may even be vision-threatening. Therefore, being aware of the complications of this phase is crucial to preserve vision. There are many classifications and guidelines for diagnosis and treatment based on reducing orbit inflammation to avoid disabling sequels, with corticosteroid therapy as the axis. However, currently there are many alternatives available involving immunomodulating drugs, which seem highly promising. In the inactive phase of the disease, characterized by the presence of the sequels of the inflammatory phase, a series of surgical procedures can be performed with the aim of improving the quality of life of these patients, as well as their aesthetic appearance. Imaging studies are vital both in the active phase, since they provide information on the orbital structures involved, and in the burnt out phase, to evaluate the surgical plan. In this update we will revise all the aspects of this disease and the guidelines for its diagnosis and treatment, but we also present a treatment algorithm to improve its understanding.
Palabras clave: Graves’ ophthalmopathy, thyroid eye disease, dysthyroid ophthalmopathy, dysthyroid orbitopathy, endocrine ophthalmopathy.
Doença dos olhos da tireoide
RESUMO
A doença ocular da tireoide é uma anormalidade de origem autoimune, mais comum em mulheres com hipertireoidismo de meia-idade, caracterizada por inflamação orbitária devido à infiltração de linfócitos e células plasmáticas com mucopolissacarídeos que causam expansão e fibrose dos músculos extraoculares e do tecido adiposo. Essas alterações orbitais podem ocorrer antes, junto ou após a disfunção tireoidiana, embora a importância de se atingir o estado eutireoidiano seja fundamental em sua evolução. Existem fatores de risco que agravam a doença, sendo a cessação do tabagismo fundamental para um bom manejo no tratamento. A doença ocorre em dois períodos: o estágio ativo ou inflamatório e o estágio inativo ou sequelar.
Na fase ativa da doença, com duração de 6 a 18/24 meses, as manifestações clínicas são muito variadas: desde episódios leves a quadros graves que podem até comprometer a visão. Portanto, reconhecer as complicações dessa fase é fundamental para preservá-la. Existem muitas classificações e diretrizes para diagnóstico e tratamento baseados na desinflamação da órbita para evitar sequelas incapacitantes, onde a corticoterapia é seu eixo, embora atualmente existam muitas alternativas de inmunomoduladores que parecem muito promissoras. Na fase inativa da doença, caracterizada pelas sequelas da fase inflamatória, uma sequência de cirurgias pode ser realizada para melhorar a qualidade de vida desses pacientes, bem como para controlar sua aparência estética. A obtenção de imagens é prioritária tanto na fase ativa, para orientar quais estruturas orbitais são afetadas, quanto na fase sequencial, para avaliar o plano cirúrgico. Nesta atualização, revisaremos todos os aspectos desta doença, o diagnóstico e as diretrizes de tratamento e apresentaremos um algoritmo de tratamento para melhor compreensão.
Palavras chave: oftalmopatia de Graves, doença ocular da tiroide, oftalmopatia distireoidiana, orbitopatia distireóide, oftalmopatia endócrina.
INTRODUCCIÓN
Se conoce como enfermedad ocular tiroidea a un conjunto de signos y síntomas oculares y orbitarios de carácter inflamatorio y naturaleza autoinmune, y que en la mayoría de los casos se encuentran asociados a una disfunción de la glándula tiroidea (por lo general, hipertiroideos). Representa la miositis más frecuente de la órbita.
La primera descripción de la enfermedad —llamada “oftalmopatía tiroidea”— la hizo un médico clínico en 1786 que describió un cuadro de “aumento de la glándula tiroidea en conexión con agrandamiento cardíaco o palpitaciones y con ojos que protruyen de sus órbitas”1. Durante los años 1834-1835 otro médico clínico describió a cuatro mujeres con palpitaciones e inflamación tiroidea, aparente agrandamiento de los globos oculares, dificultad para el cierre palpebral y aumento de la exposición escleral alrededor de la córnea.
Cinco años después, en 1840, un médico de origen alemán describió pacientes de similares características pero agregó que los globos oculares eran por demás saludables y con función visual normal, aunque las pacientes dormían con los ojos abiertos y estos estaban más separados de lo habitual.
Con el tiempo la descripción del cuadro ocular asociado a la enfermedad tiroidea fue haciéndose más detallada y adoptando diferentes nombres como oftalmopatía distiroidea (aún muy popular), oftalmopatía tiroidea, orbitopatía tiroidea, exoftalmos tirotóxico, proptosis endocrina, exoftalmos maligno, oftalmopatía de Graves (GO, por sus siglas en inglés) hasta enfermedad ocular tiroidea, como se la conoce actualmente (del inglés: thyroid eye disease o TED)1.
El objetivo del presente texto es revisar la bibliografía actual existente sobre la enfermedad ocular tiroidea para presentar conceptos claros del tema. Buscamos aportar guías que ayuden al diagnóstico, clasificación y manejo, generando herramientas útiles para el oftalmólogo general a la hora de enfrentarse ante un cuadro de muy amplia variedad de presentación y evolución.
DEFINICIÓN
La enfermedad ocular tiroidea (TED) es un desorden inflamatorio de las estructuras oculares, orbitarias y palpebrales, asociado a un componente autoinmune y en la mayoría de los casos, a una alteración en la función tiroidea. Se caracteriza por inflamación orbitaria con infiltración de linfocitos y mucopolisacáridos que causan expansión de los músculos extraoculares, y en menor medida del tejido graso orbitario.
Es la patología orbitaria más frecuente en adultos y la principal causa de proptosis tanto uni como bilateral2. Se estima que tiene una incidencia anual en Estados Unidos de 16 mujeres y 3 hombres cada 100 mil habitantes3.
Si bien inicialmente fue descrita en pacientes hipertiroideos y estos son los más frecuentemente afectados, hoy se sabe que esta patología puede presentarse en pacientes eutiroideos e hipotiroideos4 con componente autoinmune mediado por anticuerpos producidos por la glándula tiroidea. Estudios recientes demuestran que la mayoría de los pacientes con hipertiroidismo de Graves sin compromiso ocular en la presentación que son tratados con fármacos antitiroideos no desarrollan la enfermedad ocular después un seguimiento de 18 meses y que en aquellos con compromiso ocular leve desaparece espontáneamente en la mayoría de los casos. Por otro lado, la enfermedad ocular tiroidea puede preceder, suceder o seguir a las manifestaciones endocrinas pero tiende a presentarse dentro de los 18 meses en la mayoría de los pacientes5.
FISIOPATOLOGÍA
Las alteraciones patológicas en TED involucran tanto los músculos extraoculares (MEO) como la grasa orbitaria, principalmente. La proptosis, signo frecuente, es consecuencia de la expansión de los tejidos orbitarios en un continente inexpansible como lo es la órbita ósea. Esto también trae aparejado el aumento de la presión dentro de la órbita generando alteraciones del flujo sanguíneo venoso, con la consecuente congestión y edema de los tejidos periorbitarios, y aumento de la presión ocular. Esta última se debe en parte a la dificultad de drenaje del humor acuoso por las alteraciones en el flujo venoso sanguíneo periocular y debe diferenciarse del glaucoma crónico simple.
En la patogénesis de esta enfermedad pueden diferenciarse cuatro procesos patológicos:
1. Inflamación de los tejidos blandos periorbitarios.
2. Sobreproducción de glicosaminoglicanos (GAGs) por parte de los fibroblastos orbitarios.
3. Hiperplasia del tejido adiposo.
4. Otros: factores mecánicos y vasculares, mediadores químicos de la inflamación, etc.
En el examen histológico se evidencian depósitos de GAGs en los MEO, principalmente ácido hialurónico (HA) y condroitín sulfato (mucopolisacáridos). Este aumento de GAGs actúan como componentes osmóticos, llevando a la acumulación de líquido en los MOE (edema), aumento de su tamaño y disrupción de sus fibras. Otro hallazgo histológico importante es la infiltración de linfocitos y fibrosis en etapas tardías en los músculos, lo que también puede hallarse en menor cuantía en la grasa orbitaria4.
Actualmente se sabe que los fibroblastos de la órbita tienen características propias de esta localización y son los principales mediadores de la fisiopatología de TED. Estos tienen la potencialidad de transformarse en adipocitos o miofibroblastos, producir GAGs e interactuar con las células del sistema inmunológico que perpetúan el mecanismo inflamatorio. Tienen mayor respuesta inflamatoria y capacidad de producir citoquinas que los fibroblastos normales.
En la superficie de los fibroblastos orbitarios hay receptores TSH (TSHR) y receptores para el factor de crecimiento símil insulina 1 (IGF-1R) que activados regulan la producción de HA. Otro mediador de activación para la producción de GAGs es la IL 1 beta, la cual es inhibida por corticoides.
Además de la diferenciación de fibroblastos en adipocitos, también existe adipogénesis de novo en TED. Esta es mediada también por TSHR y IGF-1R.
AUTOANTÍGENOS EN TED
El principal autoantígeno que desencadena TED en pacientes con enfermedad de Graves es el receptor TSH (TSHR). El concepto de que el inicio de TED ocurre frecuentemente dentro de los primeros meses de la enfermedad de Graves se basa en la idea de que ambas entidades clínicas son desencadenadas por un autoantígeno común.
Se ha identificado que los fibroblastos de la órbita normalmente expresan TSHR, pero en mucha menor cantidad que las células de la glándula tiroides. Sin embargo esta expresión aumenta durante la adipogénesis y en TED activa. Los títulos de anticuerpos anti TSH han demostrado estar significativamente correlacionados con la actividad y severidad de TED, por lo que se infiere que TSHR es patogénico en TED.
El IGF 1R regula adipogénesis, reclutamiento y diferenciación de linfocitos, inducción de IL-16 y síntesis de HA. Se ha demostrado que sus niveles en órbita están elevados por encima de lo normal en pacientes con TED. Sin embargo, sus anticuerpos en sangre son similares a los de la población control, por lo que no sirve como parámetro clínico para evaluar la actividad de la enfermedad4.
Por lo antes mencionado, los anticuerpos antirreceptor de TSH resultan de mayor utilidad para el diagnóstico de la enfermedad ocular tiroidea.
EPIDEMIOLOGÍA Y FACTORES DE RIESGO
La enfermedad ocular tiroidea es la manifestación extratiroidea más común y más importante de la enfermedad de Graves2. Tiene predilección por el género femenino, sin embargo las formas más severas se presentan en el género masculino. Se estima que tiene una incidencia anual en Estados Unidos de 16 mujeres y 3 hombres cada 100.000 habitantes1, 3. Afecta a todas las razas por igual, pero parece tener peor evolución en la raza negra.
Según datos publicados en la serie de Bartley y colaboradores la edad media reportada al diagnóstico de la oftalmopatía fue de 43,4 años, mientras que la edad media al diagnóstico de la disfunción tiroidea fue de 41,0 años5.
Se han descrito diversos factores de riesgo asociados al desarrollo de la enfermedad ocular y/o a su peor evolución. A continuación se desarrollan los más relevantes:
Estrés oxidativo
Se ha detectado un aumento de estrés oxidativo en TED, lo que genera daño celular y del ADN con inflamación y pérdida de la función. Los niveles de ciertas enzimas peroxidasas en orina se ven aumentados en TED y tienen correlación con la actividad de la enfermedad.
El estrés oxidativo induce citoquinas proinflamatorias y estimula la proliferación de fibroblastos orbitarios de manera independiente; este efecto puede inhibirse con agentes antioxidantes6.
Tabaquismo
A pesar de estar establecida la asociación entre el hábito tabáquico y TED, su mecanismo de acción no está definido aún4, 7. Se postula que podría deberse a que el tabaquismo aumenta el estrés oxidativo, pero también los extractos del humo del cigarrillo demostraron estimular la producción de HA, la adipogénesis y aumentar la expresión de anticuerpos anti Rc de TSH4.
Además el hábito tabáquico se ha asociado a formas más graves de la enfermedad, mala respuesta al tratamiento y peor pronóstico. Es por esto que pacientes fumadores exhiben cuadros más floridos de la enfermedad, con más inflamación y evolución tórpida. También se sabe que el cese tabáquico favorece muchísimo a la evolución y es por eso que debe recomendarse siempre esta conducta ante un diagnóstico de TED8.
Disfunción tiroidea
Si bien TED puede encontrarse en pacientes eutiroideos, es mucho más frecuente en pacientes hipertiroideos, hipotiroideos con o sin enfermedad de Hashimoto9. También se ha demostrado que pacientes con algún tipo de disfunción tiroidea muestran formas más severas de la enfermedad y evolución más tórpida del cuadro, y que al regularizar el estado tiroideo se puede ver una mejoría de los signos y síntomas de la enfermedad ocular (en algunos casos)7.
Yodo radiactivo 131
Este tratamiento tiene como objetivo llevar al paciente al estado de eutiroidismo —o hipotiroidismo en su defecto— mediante una tiroiditis por radiación y destrucción glandular. Se observa un aumento de los receptores TSH y de la actividad de los anticuerpos estimulantes de tiroides, lo cual puede iniciar o empeorar TED8. Para reducir este efecto pueden administrarse corticoides peritratamiento; esta indicación dependerá de la severidad de TED previa o de los factores de riesgo para su desarrollo. Por ejemplo, en pacientes sin TED y sin factores de riesgo, o con TED inactivo, debe realizarse un seguimiento estrecho; en cambio, en pacientes con TED previo o sin TED pero con factores de riesgo para su desarrollo (principalmente tabaquismo), se recomienda administrar corticoides orales en esquema de 0.2 a 0.5 mg por kilo por día, iniciando 2 o 3 días previo al tratamiento con I131 y continuarlo por un mes con descenso gradual por 2 a 3 meses7, 10.
MANIFESTACIONES CLÍNICAS
Las manifestaciones clínicas de TED pueden ser muy variadas: desde cuadros leves como molestias de superficie, hasta cuadros graves con afectación visual como la neuropatía óptica o exposición corneal severa con úlceras y perforación. Éstas pueden explicarse mecánicamente por la discrepancia entre el aumento del volumen de tejidos orbitarios inflamados y el volumen inexpansible de la órbita ósea. Estos tejidos en expansión desplazan el globo ocular dificultando el retorno venoso, lo cual, combinado con la producción local de citoquinas y otros mediadores de la inflamación, resultan en dolor, proptosis, edema periorbitario, congestión conjuntival y quemosis, entre otros8-9.
La manifestación clínica más frecuente y de las primeras en aparecer es la retracción palpebral tanto del párpado superior como del inferior, caracterizada por la exposición del limbo esclerocorneal (fig. 1). Se encuentra en la mayoría de los pacientes y es criterio diagnóstico de TED9, 11-12. Sobre ésta se han descrito múltiples etiologías. Se observó que si bien la proptosis puede contribuir, es un factor bastante menor. Se ha propuesto que la sobreacción simpática por acción hiperadrenérgica en los pacientes con Graves es un factor contribuyente. Algunos autores sugieren que existen receptores adrenérgicos en el músculo de Müller y en el músculo elevador del párpado superior (MEPS), y que su sobreestimulación generaría la retracción palpebral relacionada con TED. Otros mecanismos propuestos son la sobreacción del MEPS, ya sea por hipertrofia o por contracción del recto superior, la inflamación y fibrosis del músculo de Müller13.

Figura 1. Retracción palpebral superior. Manifestación clínica más frecuente.
Dentro de las manifestaciones clínicas, a la retracción palpebral le sigue en frecuencia la proptosis (fig. 2). Ésta puede ser uni o bilateral, pero es más frecuente la segunda (80% de todas las proptosis bilaterales)2. Se caracteriza por ser axial y se debe principalmente al engrosamiento de los músculos extraoculares y a la expansión del componente graso de la órbita. Se suele decir que los rectos inferior y medial están más comúnmente involucrados, pero todos los músculos orbitarios pueden comprometerse, incluso estudios recientes demuestran compromiso del complejo elevador-recto superior por sobre el resto de los músculos13. El aumento del volumen muscular típicamente involucra los vientres musculares respetando el tendón y el engrosamiento de estos en la órbita posterior estrecha contribuye a la neuropatía óptica compresiva, complicación grave de esta patología10, 13.
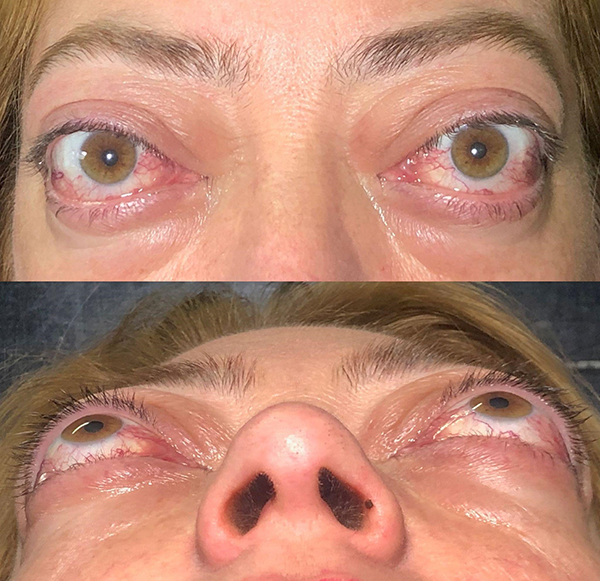
Figura 2. Enfermedad ocular tiroidea activa moderada: CAS mayor a 4. A) Retracción palpebral, inyección conjuntival y caruncular. B) Proptosis, hertel 28 mm ambos ojos.
Otras manifestaciones del cuadro clínico son edema palpebral y eritema, congestión conjuntival, quemosis, ojo seco, queratopatía por exposición, limitación de la motilidad ocular y diplopía (fig. 3), y en casos severos, neuropatía óptica compresiva. El edema palpebral es una manifestación común de TED, que puede ser unilateral o bilateral. Se postula que posiblemente esté relacionado con una reducción del drenaje linfático por disminución de la motilidad del párpado, asociada con retracción palpebral y proptosis13.
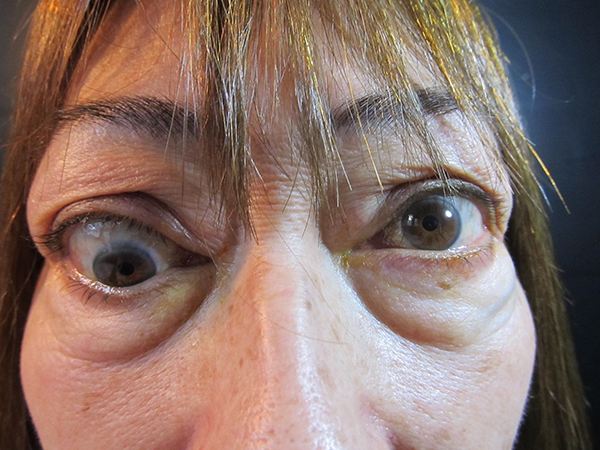
Figura 3. Paciente en etapa inactiva: restricción de la motilidad, proptosis derecha, retracción palpebral bilateral.
Se entiende que la enfermedad ocular tiroidea es autolimitada y presenta un curso bifásico, con una fase activa que puede durar entre 6 a 18 meses2, seguida de una fase de estabilidad o inactividad. Es durante la primera donde se producen la mayor cantidad de cambios —en su mayoría de origen inflamatorio— que pueden llegar a secuelas irreversibles tanto visuales y funcionales como cosméticas, y por ello la mayoría de los tratamientos antiinflamatorios e inmunomoduladores se utilizan en estas etapas9. Esta clínica bifásica ha sido descrita como una curva en la cual durante la fase inicial los signos y síntomas empeoran rápidamente hasta un pico de máxima severidad, posteriormente adoptando una forma de meseta o estabilidad con mejoras que no llegan al estado de base o normalidad (fase de estabilidad)2. En esta fase crónica, el fenómeno inflamatorio produce cambios por fibrosis dejando secuelas estéticas en las facciones del paciente, lo que genera un impacto negativo en su calidad de vida13.
Además de los factores de riesgo antes mencionados se han identificado algunos factores que se consideran predictivos para el desarrollo de formas más graves de la enfermedad: género masculino, mayor edad, tabaquismo, rápida evolución de la orbitopatía y diabetes9.
FENOTIPOS
Se han descrito diferentes fenotipos para clasificar a los pacientes con TED según la predominancia de ciertos signos y síntomas en su presentación. Una muy difundida es la clasificación de Nunery et al. que divide en tipo I o variante lipogénica y tipo II o variante muscular (fig. 4)14. La primera se caracteriza por proptosis importante, generalmente asimétrica a predominio de expansión grasa evidenciable en imágenes. Suelen tener poco aumento del tamaño muscular con buena o regular motilidad, escasos signos inflamatorios y se trata de pacientes por lo general jóvenes. El tipo II se trata de pacientes mayores con poca o nula proptosis que puede ser unilateral, mucha restricción a la motilidad ocular, que genera diplopía por lo general en todas las direcciones de la mirada, y un aumento importante del tamaño de los músculos extraoculares en imágenes. Estos pacientes con frecuencia tienen órbitas pequeñas y suelen ser más susceptibles a neuropatías ópticas compresivas.
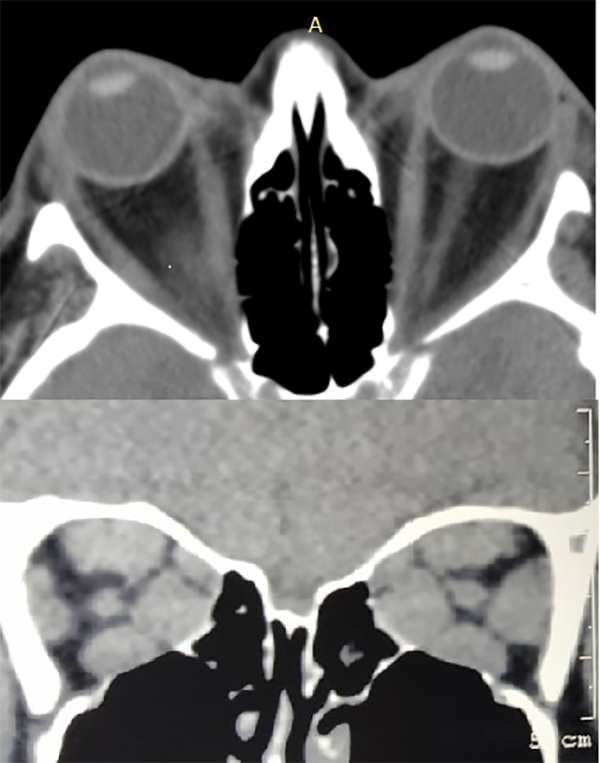
Figura 4. A) TC corte axial: componente graso. Nervio óptico elongado. B) TC corte coronal: componente muscular. Ambos casos en pacientes cursando enfermedad ocular tiroidea activa.
Otro fenotipo descrito por Rose habla del subtipo “hidráulico”15. En este caso los pacientes suelen diagnosticarse como activos, mientras que sus signos y síntomas se deben a la congestión vascular como consecuencia de procesos compresivos.
ESTUDIOS POR IMÁGENES
Las imágenes no son necesarias para el diagnóstico de TED, ya que éste se basa en la clínica y los estudios de laboratorio. Sin embargo, son de extrema utilidad para complementar la evaluación del paciente y decidir conductas terapéuticas. Se ha comprobado que los estudios por imágenes muestran alteraciones asociadas a TED en el 90% de los casos y resultan de gran ayuda en casos de pacientes eutiroideos. Por otro lado, en muchas situaciones sirven para descartar otras patologías aportando al diagnóstico diferencial. Al poner en evidencia el remodelado tisular, cambios óseos y relaciones de las estructuras orbitarias entre sí, en ciertos casos permiten predecir y prevenir lesiones graves como neuropatía óptica compresiva (fig. 5)16.
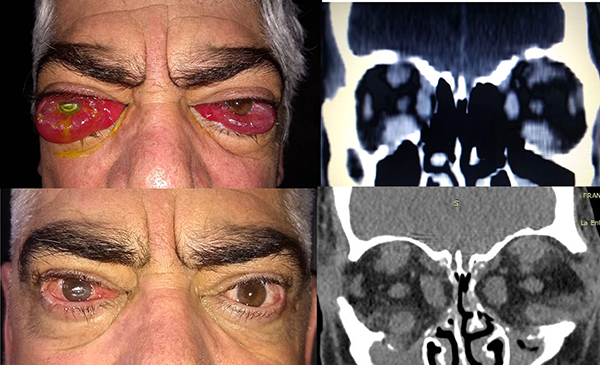
Figura 5. Enfermedad ocular tiroidea grave. A) Prequirúrgico: neuropatía óptica bilateral y queratitis exposicional del OD. B) Posquirúrgico a los 2 meses de: descompresión orbitaria tres paredes bilateral de urgencia más pulsoterapia de prednisona 1 gramo por tres días.
El primer estudio que se debe pedir ante sospecha o diagnóstico de TED es una tomografía computada simple de órbitas, con cortes axiales, coronales y sagitales finos. Resulta de utilidad agregar también tomografía de encéfalo y senos paranasales, que aportarán información para descartar otras patologías y, en caso de ser necesario, realizar algún abordaje quirúrgico posterior. Los hallazgos más frecuentes en este estudio son proptosis axial uni o bilateral, agrandamiento de los músculos extraoculares (en la mayoría de los casos con respeto del tendón) y expansión del componente graso orbitario (hipodenso). Es importante analizar la situación del nervio óptico: si se encuentra elongado por la proptosis o comprimido en el ápex por el aumento de tamaño del cono muscular (fig. 4). Esto último es crucial para detectar en forma temprana una neuropatía óptica.
El uso de la RNM en la evaluación de pacientes con TED se ha popularizado más en los últimos tiempos. Su principal ventaja es una mejor evaluación de los tejidos blandos orbitarios (principalmente músculo y grasa) y con técnicas modernas se puede evaluar el estado inflamatorio y de actividad de la enfermedad orbitaria17. Algunos estudios indican que la proptosis severa en muchos casos no siempre se debe al aumento del tamaño muscular y que la grasa inflamada y expandida también jugaría un papel importante, principalmente en casos de TED activo18. Un aumento en la intensidad de la señal en T2 puede indicar cambios edematosos causados por inflamación (de causa autoinmune o por congestión vascular), ya que los tiempos de relajación en T2 reflejan contenido acuoso en los tejidos. Esto trae una gran ventaja sobre la tomografía computada que no puede diferenciar si el aumento del tamaño muscular es por inflamación activa o fibrosis17, 19. También nos ayudará a predecir si un tratamiento antiinflamatorio será efectivo o si la diplopía puede resolverse con tratamientos médicos, o su causa responde a características secuelares y requerirá cirugía19.
Además de los métodos mencionados, existen otros estudios complementarios cuya utilidad en TED está aún en estudio, como por ejemplo el doppler de arterias carótida interna, oftálmica y central de la retina, cuyo flujo suele mejorar posterior a cirugías descompresivas. Parámetros de OCT como el espesor coroideo y la vascularización del nervio óptico podrían correlacionarse con neuropatía óptica compresiva y ser indicativos de tratamiento urgente20.
CLASIFICACIÓN Y GUÍAS
Para facilitar la comprensión de este cuadro y organizar su manejo se ha desarrollado una serie de guías prácticas que buscan clasificar a los pacientes según diferentes criterios para definir, por un lado, severidad del cuadro y, por otro, actividad de la enfermedad ocular21.
Se desarrollarán a continuación algunas de las más utilizadas.
A) En 1969 Werner reportó la clasificación NO SPECS (por sus siglas en inglés: No signs or symptoms, Only signs, Soft tissue involvement, Proptosis, Extraocular muscle signs, Corneal involvement, Sight loss)22; en 1977 publicaron una modificación23. Cada ítem representa un puntaje de 0 a 6 y a su vez dentro de cada uno existen subcategorías a, b, c y d. Esta clasificación categoriza a la enfermedad según su severidad teniendo en cuenta la clínica del paciente, pero no permite determinar el grado de actividad o inactividad del cuadro. Por lo mencionado, no pueden tomarse decisiones terapéuticas basadas en ella.
B) Más adelante, en 1989, Mourits y colaboradores describieron la clasificación CAS (Clinical Activity Score)24 ampliamente utilizada en la actualidad, la cual se basa en signos inflamatorios agudos y por lo tanto permite determinar el estado de actividad de la enfermedad. Los signos que se evalúan son: dolor (retroocular o a los movimientos), enrojecimiento (de párpados o de conjuntiva), inflamación (quemosis, quemosis caruncular, edema de párpados, aumento de la proptosis) y alteración de la función visual (disminución de los movimientos oculares, disminución de agudeza visual de una línea o más). Todos los ítems son evaluados durante la primera consulta, excepto los cambios en la proptosis, en la agudeza visual y en la motilidad ocular, que se determinan en las consultas siguientes ya que necesitan un dato de base para registrarse y estimar así su progresión. A cada signo se le otorga un valor de un punto si está presente y la suma de estos puntos da el valor del CAS. Se considera que un paciente con una valoración de CAS igual o mayor a 4 se encuentra en actividad (fig. 2) y tiene un 80% de probabilidades de mejorar con tratamiento antiinflamatorio como inmunoterapia o radioterapia (modificación de CAS 197)25. Por lo tanto, esta clasificación no sólo determina actividad sino que también es útil a la hora de predecir la respuesta a tratamientos como corticoides, una de las herramientas terapéuticas más utilizadas en estos cuadros (tabla 1).
Tabla 1. Diez ítems del CAS.
DOLOR |
1. Dolor, sensación de opresión sobre o detrás del globo ocular durante las últimas 4 semanas. |
ENROJECIMIENTO |
3. Eritema de párpados. |
INFLAMACIÓN |
5. Inflamación de los párpados. |
DETERIORO FUNCIONAL |
9. Disminución de la motilidad ocular en cualquier dirección durante un período de 1-3 meses. |
Tomado de: Mourits MP, Prummel MF, Wiersinga WM, Koornneef L. Clinical activity score as a guide in the management of patients with Graves’ ophthalmopathy. Clin Endocrinol 1997;47: 10.
Basadas en estas clasificaciones surgieron dos guías principales que se conocen ampliamente y se emplean en la actualidad:la guía VISA y la guía EUGOGO.
C) La guía VISA (Visión Inflammation Strabismus Appearance/exposure) fue desarrollada en 2006 por Dolman y Rootman26. Cada sección evalúa variables medibles subjetiva y objetivamente. Proporciona una tabla para registrar los síntomas y los signos. Después de cada sección se indica la progresión como igual, mejor o peor, de acuerdo con la perspectiva del médico y del paciente. Todas las secciones se evalúan y registran en detalle, con medidas tales como agudeza visual con y sin corrección, medición de la retracción palpebral y show escleral, protrusión de bolsas grasas, fondo de ojos, medición de los ángulos de motilidad ocular con prismas, por mencionar solo algunos de ellos. Finalmente los ítems se gradúan como neuropatía óptica sí o no, inflamación en escala de 0 a 8, estrabismo y retracción de 0 a 3, y la apariencia como leve, moderada o severa. Las secciones se disponen en el orden que deben evaluarse y se manejan de acuerdo con su importancia (visión primero, apariencia último). Si bien en su estudio Dolman y Rootman reportaron una coincidencia interobservador del 90% utilizando esta guía para clasificar a los pacientes, su principal limitación está en el hecho de que no proporciona lineamientos tan claros en cuanto a las medidas terapéuticas a tomar en cada caso según el puntaje. Por otro lado, pese a que la gran cantidad de información que recaba y el detalle con que se registra puede consumir mucho tiempo y dificultar su comprensión; es una herramienta muy útil como base de datos para estudios clínicos o investigaciones.
D) Entre 1999 y 2006 el Grupo Europeo de Orbitopatía de Graves (EUGOGO, por sus siglas en inglés European Group On Graves’ Orbitopathy) realizaron una serie de consensos para los que se reunieron oftalmólogos y endocrinólogos de 12 países europeos27.
Bartalena y colaboradores publicaron en 2016 en el European Thyroid Journal la versión más actualizada de estos consensos conformando una guía práctica para evaluación y manejo10. Esta guía presenta en forma clara y concisa las formas de estudiar y manejar diferentes aspectos de esta enfermedad. Estas recomendaciones son: enfoque clínico general que debería recibir el paciente para mejorar su calidad de vida, evaluar actividad (mediante CAS) y severidad (guía propia modificada de NOSPECS), criterios de derivación, manejo de factores de riesgo (tabaquismo y disfunción tiroidea) y uso de tratamientos tópicos en todos los estadios de la enfermedad. Luego de esta evaluación presenta guías de manejo para TED leve, activo, moderado y severo; este último con complicaciones como neuropatía óptica. Finalmente trata el manejo de la enfermedad inactiva dando indicaciones para cirugía de rehabilitación cosmética. Una gran ventaja de esta guía es la forma práctica en la que se presentan las clasificaciones y cómo actuar según estas. Aporta indicaciones terapéuticas claras con dosis de medicación sugeridas y vía de administración, tanto para tratamientos de primera línea (corticoides) como de segunda (radioterapia, ciclosporina, etc.). Por lo antes expuesto consideramos que es la guía más clara y práctica para orientar el manejo de estos pacientes, tanto para el oftalmólogo general como para el especialista.
TRATAMIENTO
El manejo de este tipo de pacientes puede resultar sencillo en casos leves; sin embargo, en pacientes moderados y severos puede ser un verdadero desafío obtener un adecuado control de la enfermedad. Por lo tanto, es útil valerse de algunas de las guías antes mencionadas para intentar clasificar a los pacientes en una categoría de acuerdo con su severidad y su grado de actividad e indicar un manejo acorde a esto.
Como primera medida ante todos estos pacientes, cualquiera sea su severidad o actividad, se debe realizar un adecuado control de factores de riesgo. Esta estrategia comprende control de su estado tiroideo mediante consulta a su endocrinólogo, cesación tabáquica, profilaxis con corticoides en caso de tratamiento con yodo radioactivo (con las pautas mencionadas previamente) y control de la glucemia en casos de pacientes diabéticos.
Los pacientes leves, sin actividad o con escasa sintomatología, se manejarán de manera ambulatoria con tratamientos médicos, en su mayoría tópicos. Se debe indicar lubricación ocular adecuada con gotas y en caso de ser necesario, geles. Algunos pacientes con marcada retracción palpebral pueden verse favorecidos con oclusión nocturna con gafas especializadas para mantener la humectación ocular (fig. 1).
El selenio es un oligoelemento que podría reducir el estrés oxidativo celular. Se ha demostrado que su suplementación en pacientes con TED leve a moderado en estadios iniciales mejora la calidad de vida, reduce la sintomatología y disminuye la progresión a formas más severas de la enfermedad. No se ha demostrado que tenga efectos en formas inactivas de larga duración de la enfermedad. Se indica un comprimido de 200 mg una vez por día por seis meses10.
Para pacientes moderados a severos, con signos y síntomas de actividad (CAS valor de 4 o mayor), además de las medidas previamente mencionadas deben recibir tratamiento antiinflamatorio con corticoides (figs. 2 y 6). Estos pueden administrarse vía oral (prednisona) o endovenosa (metilprednisolona), siendo esta última mejor tolerada y más efectiva28. Existen diferentes esquemas terapéuticos según autores y centros de atención. La guía europea EUGOGO recomienda lo siguiente: esquema de dosis intermedia 0,5 g una vez por semana durante 6 semanas y luego 0,25 g por semana por 6 semanas (dosis acumulada 4,5 g).
Esquema de dosis alta 0,75 g/semana por 6 semanas y 0,5 g/semana por 6 semanas en casos más severos (dosis acumulada 7.5 g). Los pacientes deben monitorearse clínicamente durante estos tratamientos con controles estrictos de tensión arterial, glucemia y función hepática, y la dosis total acumulada no debe superar los 8 g10.
En casos moderados de reciente comienzo y en actividad, en los cuales el aumento del tamaño muscular es marcado, y genera diplopía que afecta la calidad de vida de los pacientes, puede optarse por un tratamiento menos invasivo que los corticoides sistémicos, como lo es la aplicación de triamcinolona intraorbitaria mediante inyección parabulbar ínfero-temporal. El esquema consiste en inyectar 20 mg de acetónido de triamcinolona (presentación de 40 mg/ml) en cada órbita en forma semanal por 4 semanas consecutivas. Se ha demostrado mejoría en la diplopía y en las ducciones con alivio de la signo-sintomatología inflamatoria, mientras que no generaría cambios en la proptosis, la presión intraocular y la agudeza visual29-30.
Los corticoides aplicados localmente también pueden utilizarse para el tratamiento de la retracción palpebral en estadios tempranos de la enfermedad, donde la fisiopatología responde más a un proceso inflamatorio y no a uno cicatricial. Se ha estudiado el uso de triamcinolona 40 mg/ml inyectada a nivel del músculo elevador del párpado superior (MEPS). Esta aplicación puede ser por vía transconjuntival31 o vía percutánea32 semanalmente en esquemas que varían de 4 a 6 inyecciones en total.
Existen tratamientos alternativos o de segunda línea que han demostrado ser efectivos para pacientes que no pueden recibir corticoides o que tienen recaídas.
Radioterapia
Se ha utilizado por muchos años y actualmente se sabe que tiene un rol terapéutico en TED moderado a severo en fase activa, reduciendo la duración de esta última33. Mejora la diplopía y las ducciones, y potencia en forma sinérgica el efecto de los corticoides. Existen varios esquemas pero uno de los más utilizados es de 20 Gy por órbita, en 10 dosis diarias por 2 semanas10. Debe evitarse en pacientes con vasculitis, retinopatía diabética o cuando la inflamación orbitaria remitió espontáneamente. En pacientes resistentes a corticoides, la radioterapia pareciera no ser beneficiosa34.
Este tratamiento es para pacientes seleccionados y no se debe optar en casos en los que posteriormente se planea realizar una cirugía de descompresión orbitaria, ya que la fibrosis generada a consecuencia de la radioterapia podría comprometer el éxito de la cirugía.
Otras terapias alternativas a corticoides son los inmunomoduladores, y dentro de ellos los más estudiados en los últimos tiempos son los anticuerpos monoclonales35-36.
Anticuerpos monoclonales
Rituximab
Es un anticuerpo monoclonal anti CD20 que ataca células B en estadios intermedios de maduración y plasmocitos jóvenes. Los resultados de los distintos ensayos clínicos realizados con rituximab en TED son contradictorios, y por lo tanto no puede considerarse tratamiento de primera línea o reemplazo de corticoides. Sin embargo, en algunas series de casos ha demostrado mejorar el CAS, la motilidad y la diplopía. Por lo tanto debería reservarse para ocasiones resistentes a corticoides o cuando estos están contraindicados35.
Tocilizumab
Es un anticuerpo monoclonal antirreceptor de interleucina 6. En un ensayo clínico controlado demostró reducir la inflamación orbitaria y proptosis en pacientes resistentes a corticoides al compararse con placebo. Actualmente tendría un rol para pacientes con TED activo moderado a severo y faltan estudios para determinar su eficacia en neuropatía óptica35, 37.
Teprotumumab
Es un anticuerpo monoclonal contra el receptor de factor de crecimiento símil insulina (IGF-1), que tiene un importante rol en la fisiopatología de TED modulando y aumentando las acciones patológicas del receptor de TSH. En ensayos clínicos controlados ha demostrado reducción significativa del CAS en dos o más puntos, y reducción del exoftalmos en un promedio de 2.46 mm, siendo este último resultado comparable a la cirugía y no obtenido por ningún otro tratamiento médico38. El perfil de seguridad de esta droga parece ser más que aceptable, habiéndose descrito efectos adversos leves. Se trata de una droga que modifica el curso de la enfermedad y parece ser muy prometedora18, 38.
Es importante destacar que si bien estas nuevas terapéuticas son muy sugestivas, se trata de medicamentos caros y muchas veces de difícil acceso en nuestro medio.
Otras opciones estudiadas y utilizadas como tratamientos alternativos incluyen metotrexato, azatioprina, ciclosporina, micofenolato de mofetilo, entre otros10, 35.
COMPLICACIONES
Principalmente durante las etapas activas de la enfermedad pueden darse complicaciones que ponen en riesgo la visión de los pacientes con TED. Las principales, y cuyo diagnóstico es indicación de medidas terapéuticas urgentes, son la luxación espontánea del globo ocular, la exposición corneal severa con queratitis y el riesgo de perforación ocular, los pliegues coroideos en el fondo de ojos y la neuropatía óptica9-10. Todas estas complicaciones son indicación de cirugía descompresiva urgente.
La neuropatía óptica distiroidea (del inglés: dysthyroid optic neuropathy y su sigla DON) es una complicación poco frecuente pero grave que se presenta en el 5% al 8% de los pacientes con TED (fig. 5). Su diagnóstico es principalmente clínico cursando con disminución de agudeza visual, defecto pupilar aferente relativo, alteración de la visión cromática, cambios de la papila en el fondo de ojos, alteraciones del campo visual y evidencia de crowding apical en las imágenes o nervio óptico elongado (fig. 4)10. Cabe resaltar que no todos estos signos y síntomas estarán siempre presentes, y que se debe prestar especial atención a ellos ya que pueden pasar inadvertidos durante la etapa activa de la enfermedad. Es de especial importancia la alteración de la visión cromática que puede ser el único signo de neuropatía y se presenta muy frecuentemente, mientras que los cambios en el fondo de ojo se evidencian sólo entre el 20% y el 50% de los casos.
El grado de proptosis en estos pacientes es por lo general poco evidente y no puede correlacionarse directamente con la severidad de la neuropatía. Se cree que la falta de proptosis podría incrementar la presión orbitaria generando la compresión del nervio óptico. Se ha visto que en pacientes con diabetes es más frecuente la presentación de DON y se cree que se deba a la microangiopatía asociada a esta enfermedad que dejaría al nervio óptico más susceptible a la compresión39.
En cuanto al tratamiento, el gold standard de inicio son los corticoides endovenosos10, 34, 39-40 en esquema de 1 gramo por día durante tres días, que puede repetirse de ser necesario en una semana. De no haber respuesta o no ser suficiente en un plazo de dos semanas, la conducta siguiente es la cirugía descompresiva urgente. Para ella la elección por mucho tiempo ha sido la descompresión de pared medial; sin embargo últimamente se han descrito otras técnicas igual de efectivas para lograr descompresión del nervio óptico como ser la descompresión de pared lateral profunda, la descompresión balanceada (pared medial y lateral) o la vía endoscópica para pared medial, entre otras39, 41.
Cirugía de rehabilitación o tratamiento etapa inactiva
Teniendo en cuenta de que nos encontramos ante una enfermedad autolimitada, una vez superada su fase activa se deben determinar sus secuelas para implementar tratamientos acordes, generalmente conocidos como de “rehabilitación”. La guía europea EUGOGO recomienda realizar cirugía de rehabilitación cuando las secuelas de la enfermedad ocular tiroidea se asocian a alteraciones en la función visual o en la calidad de vida de los pacientes y cuando la enfermedad ha estado inactiva por al menos 6 meses10. Estas secuelas por lo general suelen ser proptosis, diplopía, dermatochálasis y retracción palpebral (fig. 3)10, 42. Shorr y Seiff describen un abordaje para estas cirugías dividido en cuatro etapas consecutivas cuyo orden no debe alterarse: cirugía descompresiva, cirugía de estrabismo, cirugía de retracción palpebral y blefaroplastia38. Sin embargo, cabe destacar que en la actualidad algunos autores como Bernardini y colaboradores desafían esta secuencia43 alegando que las modificaciones en la retracción palpebral por cirugía descompresiva son mínimas y que podrían realizarse en el mismo acto quirúrgico42, 44.
Descompresión orbitaria
Las indicaciones para esta cirugía se han modificado con el tiempo. Inicialmente era reservada para urgencias como neuropatía óptica o exposición corneal severa (fig. 5). En la actualidad también está indicada durante la fase inactiva de la enfermedad como parte de la rehabilitación cosmética de las complicaciones10, 42.
Diferentes abordajes y técnicas se han estudiado y modificado a lo largo del tiempo: descompresión de piso y pared lateral, descompresión superior con abordaje desde la fosa craneal, descompresión de pared medial mediante etmoidectomía, descompresión combinada con abordaje transantral de pared medial y piso de la órbita. El abordaje de pared lateral por vía orbitaria se popularizó en los 90 a través de Goldberg y colaboradores, técnica que fue perfeccionada posteriormente, destacándose hoy la técnica de Piva y colaboradores descrita en 2008 y que aborda la fosa temporal45. En la actualidad, la elección del abordaje queda supeditado al grado de proptosis y a la preferencia de cada cirujano, siendo los más populares los abordajes de pared media y piso o la denominada “descompresión balanceada” que incluye pared medial y lateral profunda46-47. En casos de proptosis severa puede agregarse una tercera pared.
La descompresión orbitaria de las paredes óseas puede producir una reducción de la proptosis de entre 4-5 mm. La complicación más frecuente es la diplopía posquirúrgica, que ocurre en aproximadamente el 29% de los casos, según Jordan y colaboradores48, y se han descrito modificaciones en la técnica quirúrgica para evitarla, detalles que escapan a los objetivos de este artículo. Otras complicaciones descritas son hipoglobo, disestesias, fístula de líquido cefalorraquídeo, sinusitis.
Otro abordaje descrito para reducir la proptosis, solo o en combinación con la descompresión ósea46, es la lipectomía orbitaria anterior42, 49. Ésta consiste en la extracción de la grasa orbitaria intra y extraconal, y en algunos casos agregan la exéresis de paquetes grasos preaponeuróticos42.
Actualmente no hay consenso respecto de las modificaciones en la PIO y calidad de vida que otorga la lipectomía sola. La mayoría de los autores concuerda en que ésta debe reservarse para casos de proptosis leve a moderada (menor a 26 mm) y con predominio de expansión grasa evidenciable por imágenes49.
Cirugía de retracción palpebral
La retracción palpebral es uno de los signos más comunes de TED y es criterio diagnóstico de la enfermedad. Además de la alteración cosmética que genera, puede producir lagoftalmos, queratitis, fotofobia y lagrimeo. En la etapa crónica de la enfermedad esta retracción tiende a persistir por lo que se han descrito numerosas técnicas para corregirla.
En cuanto al párpado inferior las técnicas más empleadas son la resección o extirpación de retractores, sin o con un espaciador; este último puede ser autólogo (paladar duro, tarso contralateral, fascia lata, cartílago auricular), homólogo (esclera de banco) o sintético, y suele indicarse en casos de retracciones severas (mayores a 3 mm)11. El abordaje puede ser tanto anterior vía incisión subciliar como posterior, vía transconjuntival. En algunos casos puede ser necesario un procedimiento adyuvante como midface lifting, cantoplastias o tarsorrafias laterales para mejorar el contorno palpebral y contrarrestar el efecto de la gravedad que favorece a la retracción.
Para la corrección de la retracción palpebral superior, las cirugías actualmente más utilizadas tienen como objetivo debilitar los músculos MEPS y músculo de Müller. Esto puede lograrse mediante la sección parcial o completa (blefarotomía) de uno o ambos músculos (fig. 6). Se ha demostrado que agregar un espaciador en párpado superior no modifica los resultados posquirúrgicos en este caso, por lo que esta última técnica se ha dejado de lado.
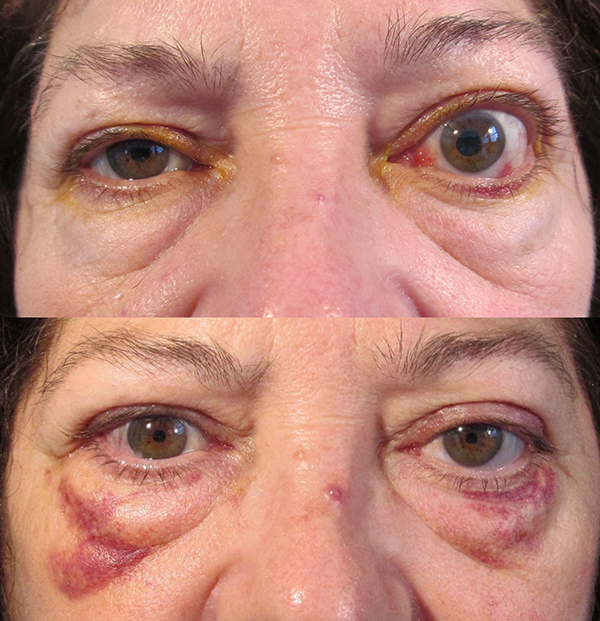
Figura 6. A) Enfermedad ocular tiroidea activa moderada. B) Postoperatorio de cirugía reparadora de retracción palpebral superior: blefarotomía izquierda más espaciador de párpado inferior izquierdo (tarso contralateral).
El abordaje puede ser anterior vía pliegue palpebral o posterior vía transconjuntival, siendo esta última la más utilizada50. Independientemente del abordaje que se utilice, en toda cirugía de retracción palpebral deberían tenerse en cuenta los siguientes puntos desarrollados por Pieroni Goncalves y colaboradores51:
1) abordar tanto músculo de Müller como el MEPS;
2) especial atención en los dos tercios laterales del párpado para corregir la retracción lateral (flare);
3) preservar un pedículo central de MEPS o conjuntiva o dejar una sutura central que conecte el tarso al elevador para obtener mejor contorno y evitar la ptosis en el eje visual;
4) seccionar la conjuntiva para tratar posibles casos de fibrosis.
Otra opción no quirúrgica para la retracción palpebral superior asociada a esta enfermedad es la toxina botulínica A. Ésta actúa en la unión neuromuscular bloqueando la liberación de acetilcolina en el MEPS provocando su debilidad temporal y su caída. Esta opción terapéutica puede ofrecerse a pacientes que no quieren operarse o en casos de queratitis severas por exposición en las fases activas de la enfermedad50.
A continuación se presenta un algoritmo terapéutico en relación con la severidad de los pacientes con TED (fig. 7).
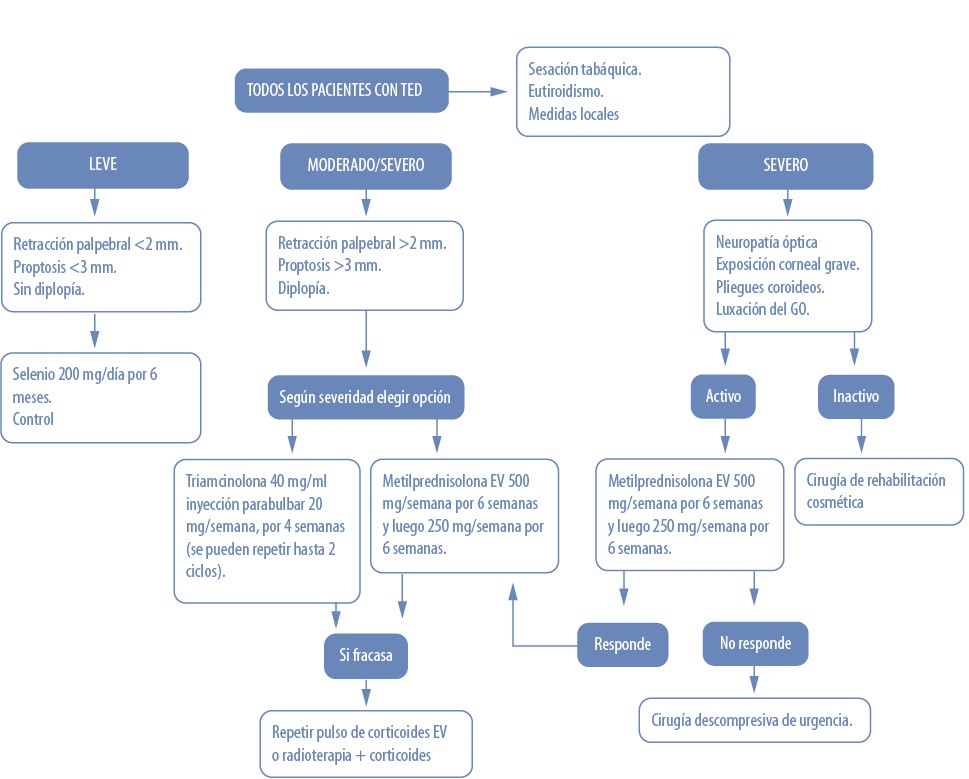
Figura 7. Algoritmo terapéutico recomendado en pacientes con TED.
CONCLUSIÓN
La enfermedad ocular tiroidea constituye la manifestación extratiroidea autoinmune más frecuente de la enfermedad de Graves (50%), puede también asociarse a otros desórdenes de la glándula tiroidea e incluso estar presente en estados de eutiroidismo. Esto es lo que hace que sea de fundamental importancia conocer esta patología por parte no sólo de los especialistas en oculoplástica sino también del oftalmólogo general.
Desde la primera descripción en 1700, donde simplemente se asociaba la disfunción tiroidea con protrusión ocular hasta nuestros días, hemos progresado enormemente en el entendimiento de esta patología, pudiendo hoy verla como un verdadero trastorno autoinmune con anticuerpos específicos dirigidos hacia los tejidos orbitarios y manejarla como tal, con terapéuticas inmunosupresoras e inmunomoduladoras dirigidas.
Consideramos de fundamental importancia destacar la gran utilidad de las diferentes guías de manejo con las que contamos actualmente, que nos permiten determinar para cada paciente un momento específico en la evolución de su enfermedad, determinar la gravedad de la misma y elegir para él el tratamiento más apropiado.
REFERENCIAS
1. Bartley GB. The epidemiologic characteristics and clinical course of ophthalmopathy associated with autoinmune thyroid disease in Olmsted County, Minesota. Trans Am Ophthalmol Soc 1994; 92: 477-588
2. Uddin JM, Rubinstein T, Hamed-Azzam S. Phenotypes of thyroid eye disease. Ophthalmic Plast Reconstr Surg 2018; 34 (4S Suppl. 1): S8-S33.
3. Bahn RS. Graves’ ophthalmopathy. N Engl J Med 2010; 362: 726-738.
4. Khong JJ, McNab AA, Ebeling PR et al. Pathogenesis of thyroid eye disease: review and update on molecular mechanisms. Br J Ophthalmol 2016; 100: 142-150.
5. Bartley GB, Fatourechi V, Kadrmas EF et al. Chronology of Graves’ ophthalmopathy in an incidence cohort. Am J Ophthalmol 1996; 121: 426-434.
6. Nilay Yuksel, Derya Yaman, Ozge Tugce Pasaoglu, and Hatice Pasaoglu.The Effect of Smoking on Mitochondrial Biogenesis in Patients With Graves Ophthalmopathy. Ophthalmic Plast Reconstr Surg 2020;36:172–177.
7. Thou S, Vinjamuri S. The relationship between thyroid eye disease and radioiodine treatment. Nucl Med Commun 2019, 40: 194-198.
8. Garrity JA, Bahn RS. Pathogenesis of Graves ophthalmopathy: implications for prediction, prevention, and treatment. Am J Ophthalmol 2006; 142: 147-153.
9. Dolman PJ. Evaluating Graves’ orbitopathy. Best Pract Res Clin Endocrinol Metab 2012; 26: 229-248.
10. Bartalena L, Baldeschi L, Boboridis K. et al. The 2016 European Thyroid Association/European Group on Graves’ Orbitopathy guidelines for the management of Graves’ orbitopathy. Eur Thyroid J 2016; 5: 9-26.
11. Ribeiro SFT, Shekhovtsova M, Duarte AF, Velasco Cruz AA. Graves lower eyelid retraction. Ophthalmic Plast Reconstr Surg 2016; 32: 161-169.
12. Joos ZP, Sullivan TJ. Peri-levator palpebrae superioris triamcinolone injection for the treatment of thyroid eye disease-associated upper eyelid retraction. Clin Exp Ophthalmol 2017; 45: 651-652.
13. Dutton JJ. Anatomic considerations in thyroid eye disease. Ophthalmic Plast Reconstr Surg 2018; 34(4S Suppl 1): S7-S12.
14. Nunery WR, Martin RT, Heinz GW, Gavin TJ. The association od cigarette smoking with clinical subtypes of ophtalmic Grave’s disease. Ophthalmic Plast Reconstr Surg 1993; 9: 77-82.
15. Rose GE. Postural visual obscurations in patients with inactive thyroid eye disease: a variant of ‘hydraulic’ disease. Eye (Lond) 2006; 20: 1178-1185.
16. Siakallis LC, Uddin JM, Miszkiel KA. Imaging investigation of thyroid eye disease. Ophthalmic Plast Reconstr Surg 2018; 34(4S Suppl. 1): S41-S51.
17. Politi LS, Godi C, Cammarata G et al. Magnetic resonance imaging with diffusion-weighted imaging in the evaluation of thyroid-associated orbitopathy: getting below the tip of the iceberg. Eur Radiol 2014; 24: 1118-1126.
18. Kvetny J, Puhakka KB, Røhl L. Magnetic resonance imaging determination of extraocular eye muscle volume in patients with thyroid-associated ophthalmopathy and proptosis. Acta Ophthalmol Scand 2006: 84: 419-423.
19. Yokoyama N, Nagataki S, Uetani M et al. Role of magnetic resonance imaging in the assessment of disease activity in thyroid-associated ophthalmopathy. Thyroid 2002; 12: 223-227.
20. Roos JCP, Murthy R. Update on the clinical assessment and management of thyroid eye disease. Curr Opin Ophthalmol 2019, 30: 401-406.
21. Barrio-Barrio J, Sabater AL, Bonet-Farriol E et al. Graves’ ophthalmopathy: VISA versus EUGOGO classification, assessment, and management. J Ophthalmol 2015; 2015: 249125.
22. Werner SC. Classification of the eye changes of Grave’s disease. J Clin Endocrinol Metab 1969; 29: 982-984.
23. Werner SC. A new classification of the eye changes of Grave’s disease: letter to the editor. Arch Ophthalmol 1969; 82: 421-423.
24. Mourits MP, Koornneef L, Wiersinga WM et al. Clinical criteria for the assessment of disease activity in Graves’ ophthalmopathy: a novel approach. Br J Ophthalmol 1989; 73: 639-644.
25. Mourits MP, Prummel MF, Wiersinga WM, Koornneef L. Clinical activity score as a guide in the management of patients with Graves’ ophthalmopathy. Clin Endocrinol (Oxf) 1997; 47: 9-14.
26. Dolman PJ, Rootman J. VISA classification for Graves orbitopathy. Ophthalmic Plast and Reconstr Surg 2006; 22: 319-324.
27. European Group on Graves’ Orbitopathy (EUGOGO); Wiersinga WM, Perros P et al. Clinical assessment of patients with Graves’ orbitopathy: the European Group on Graves’ Orbitopathy recommendations to generalists, specialists and clinical researchers. Eur J Endocrinol 2006; 155: 387-389.
28. Young SM, Lim AYN, Lang SS et al. Efficacy and safety of pulsed intravenous methylprednisolone in early active thyroid eye disease. Orbit 2019; 38: 362-369.
29. Ebner R, Devoto MH, Weil D et al. Treatment of thyroid associated ophthalmopathy with periocular injections of triamcinolone. Br J Ophthalmol 2004; 88: 1380-1386.
30. Ortiz-Basso T, Vigo RL, Sidelnik, M et al. Triamcinolone for the treatment of Graves ophthalmopathy tested with short tau inversion recovery magnetic resonance. Ophthalmic Plast Reconstr Surg 2019; 35: 22-24.
31. Young SM, Kim YD, Lang SS, Woo KI. Transconjunctival triamcinolone injection for upper lid retraction in thyroid eye disease: a new injection method. Ophthalmic Plast Reconstr Surg 2018; 34: 587-593.
32. Joos ZP, Sullivan TJ. Peri-levator palpebrae superioris triamcinolone injection for the treatment of thyroid eye disease-associated upper eyelid retraction. Clin Exp Ophthalmol 2017; 45: 651-652.
33. Godfrey KJ, Kazim M. Radiotherapy for active thyroid eye disease. Ophthalmic Plast Reconstr Surg 2018; 34(4S Suppl 1): S98-S104.
34. Gold KG, Scofield S, Isaacson SR et al. Orbital radiotherapy combined with corticosteroid treatment for thyroid eye disease-compressive optic neuropathy. Ophthalmic Plast Reconstr Surg 2018; 34: 172-177.
35. Khong JJ, McNab A. Medical treatment in thyroid eye disease in 2020. Br J Ophthalmol 2021; 105: 299-305.
36. Kahaly GJ. Immunotherapies for thyroid eye disease. Curr Opin Endocrinol Diabetes Obes 2019, 26: 250-255.
37. Pérez-Moreiras JV, Álvarez-López A, Cardiel Gómez E. Treatment of active corticosteroid-resistant Graves’ orbitopathy. Ophthalmic Plast Reconstr Surg 2014; 30: 162-167.
38. Shor N, Seiff SR. The four stages of surgical rehabilitation of the patient with dysthyroid ophthalmopathy. Ophthalmology 1986; 93: 476-483.
39. Saeed P, Rad ST, Bisschop PHLT. Dysthyroid optic neuropathy. Ophthalmic Plast Reconstr Surg 2018; 34(4S Suppl 1): S60-S67.
40. McKeag D, Lane C, Lazarus JH et al. Clinical features of dysthyroid optic neuropathy: a European Group on Graves’ Orbitopathy (EUGOGO) survey. Br J Ophthalmol 2007; 91: 455-458.
41. Tooley AA, Godfrey KJ, Kazim M. Evolution of thyroid eye disease decompression-dysthyroid optic neuropathy. Eye (Lond) 2019; 33: 206-211.
42. Rootman DB. Orbital decompression for thyroid eye disease. Surv Ophthalmol 2018; 63: 86-104.
43. Bernardini FP, Skippen B, Zambelli A et al. Simultaneous aesthetic eyelid surgery and orbital decompression for rehabilitation of thyroid eye disease: the one-stage approach. Aesthet Surg J 2018; 38: 1052-1061.
44. Ben Simon BJ, Mansury AM, Schwarcz RM et al. Simultaneous orbital decompression and correction of upper eyelid retraction versus staged procedures in thyroid-related orbitopathy. Ophthalmology 2005; 112: 923-932.
45. Chang EL, Piva AP. Temporal fossa orbital decompression for treatment of disfiguring thyroid-related orbitopathy. Ophthalmology 2008; 115: 1613-1619.
46. Leone CR Jr, Piest KL, Newman RJ. Medial and lateral wall decompression for thyroid ophthalmopathy. Am J Ophthalmol 1989; 108: 160-166.
47. Ünal M, Leri F, Konuk O, Hasanreisoglu B. Balanced orbital decompression combined with fat removal in Graves ophthalmopathy: do we really need to remove the third wall? Ophthalmic Plast Reconstr Surg 2003; 19: 112-118.
48. Mainville NP, Jordan DR. Effect of orbital decompression on diplopia in thyroid-related orbitopathy. Ophthalmic Plast Reconstr Surg 2014; 30: 137-140.
49. Willaert R, Maly T, Ninclaus V et al. Efficacy and complications of orbital fat decompression in Graves’ orbitopathy: a systematic review and meta-analysis. Int J Oral Maxillofac Surg 2020; 49: 496-504.
50. Velasco Cruz AA, Ribeiro SFT, Garcia DM et al. Graves upper eyelid retraction. Surv Ophthalmol 2013; 58: 63-76.
51. Gonçalves ACP, Nogueira T, Gonçalves ACA et al. A comparative study of full-thickness blepharotomy versus transconjunctival eyelid lengthening in the correction of upper eyelid retraction of upper eyelid retraction in Graves’ orbitopathy. Aesthetic Plast Surg 2018; 42: 215-223.