ARTÍCULO ORIGINAL
Melanoma ocular: reporte de 24 casos de la Unidad de Melanoma del Hospital de Clínicas Dr. Manuel Quintela, Montevideo, Uruguay
Andrea Sumba, Daianna Romano, Dahiana Amarillo, Andrea Schiavone, Lucia Delgado, Gabriel Krygier
Hospital de Clínicas Dr. Manuel Quintela, Montevideo, Uruguay
Recibido: 16 de abril de 2019. Aprobado: 8 de septiembre de 2019.
Correspondencia: andysum1991@gmail.com
Oftalmol Clin Exp (ISSN 1851-2658) 2020; 13(1): 11-22.
Responsabilidades éticas Confidencialidad de datos: los autores declaran la confidencialidad de los datos de los pacientes incluidos en este estudio y los que se encontraban vivos dieron su consentimiento informado por escrito para participar en el estudio.
Conflicto de interés Los autores declaran no tener algún conflicto de interés.
RESUMEN
Objetivos: Determinar las características clínico-epidemiológicas, manejo terapéutico y tasa de supervivencia de pacientes con diagnóstico de melanoma ocular a lo largo de 20 años.
Materiales y métodos: Estudio retrospectivo donde se revisaron las historias clínicas de pacientes con diagnóstico de melanoma ocular desde 1997 hasta 2017 en el Hospital de Clínicas Dr. Manuel Quintela de Montevideo, Uruguay. Para los cálculos de sobrevida se usó el método de Kaplan Meier y se consideró estadísticamente significativo un valor de p <0,05.
Resultados: Se identificaron 24 pacientes, la edad media al debut fue de 58 años; el 70,8% se presentó en mujeres y el motivo de consulta más frecuente fue la pérdida de la visión en 21 casos (88%). La localización en coroides se presentó en 15 pacientes (62,5%), seguida de cuerpo ciliar, conjuntiva e iris. La histología fue melanoma epitelioide en 9 casos (37,5%) y fusocelular en 8 casos (33,3%). La enucleación fue el tratamiento de elección en 18 pacientes (79%). Al momento del cierre, 17 casos (70,8%) se encuentran vivos y en controles. La tasa de supervivencia a los 5 años fue del 74,2% y a los 10 años, del 51,9%.
Conclusiones: En Montevideo, las características clínico-epidemiológicas y de supervivencia del melanoma ocular concuerdan con series internacionales. Esperamos que este estudio pueda ayudar a mejorar el conocimiento de la enfermedad y de las opciones terapéuticas disponibles en la región.
Palabras clave: melanoma ocular, enucleación, sobrevida.
Ocular melanoma: a report of 24 cases at the Melanoma Unit of Hospital de Clínicas Dr. Manuel Quntela, Montevideo, Uruguay
ABSTRACT
Objectives: To determine the clinical-epidemiologic features, therapeutic management and survival rate of patients diagnosed with ocular melanoma over 20 years.
Materials and methods: Retrospective study involving a review of the clinical reports of patients diagnosed with ocular melanoma from 1997 to 2017 at Hospital de Clínicas Dr. Manuel Quintela of Montevideo, Uruguay. The Kaplan-Meier method was used to estimate the survival rate, with statistical significance set at a value of p < 0.05.
Results: A total of 24 patients were identified. Mean age at onset was 58 years; 70.8% were women and the most common reason for consultation was visual loss in 21 cases (88%). Choroidal localization was recorded in 15 patients (62.5%), followed by the ciliary body, the conjunctiva and iris. Histology revealed epithelioid melanoma in 9 cases (37.5%) and spindle cell melanoma in 8 cases (33.3%). Enucleation was the treatment of choice in 18 patients (79%). Upon completion of this study, 17 cases (70.8%) were alive and controlled. The 5-year-survival rate was 74.2% and 51.9% after 10 years.
Conclusions: In Montevideo, the clinical-epidemiologic features and survival rate of ocular melanoma are consistent with international figures. We hope this study will help improve knowledge of the disease and of therapeutic options available in the region.
Keywords: ocular melanoma, enucleation, survival.
Melanoma ocular: reporte de 24 casos da Unidade de Melanoma do Hospital de Clínicas Dr. Manuel Quintela, Montevideo, Uruguai
RESUMO
Objetivos: Determinar as características clínico-epidemiológicas, manejo terapêutico e taxa de supervi
vência de pacientes com diagnóstico de melanoma ocular ao longo de 20 anos.
Materiais e métodos: Estudo retrospectivo onde se revisaram as histórias clínicas de pacientes com diagnóstico de melanoma ocular desde 1997 até 2017 no Hospital de Clínicas Dr. Manuel Quintela de Montevideo, Uruguai. Para os cálculos de sobrevida se usou o método de Kaplan Meier e se considerou estatisticamente significativo um valor de p <0,05.
Resultados: Identificaram-se 24 pacientes, a média da idade na estreia foi de 58 anos; 70,8% se apresentou em mulheres e o motivo de consulta mais frequente foi a perda da visão em 21 casos (88%). A localização em coroide se presentou em 15 pacientes (62,5%), seguida de corpo ciliar, conjuntiva e íris. A histologia foi melanoma epitelióide em 9 casos (37,5%) e fusocelular em 8 casos (33,3%). A enucleação foi o tratamento escolhido por 18 pacientes (79%). Ao momento do encerramento, 17 casos (70,8%) se encontraram vivos e em controles. A taxa de supervivência aos 5 anos foi de 74,2% e aos 10 anos, de 51,9%.
Conclusões: Em Montevideo, as características clínico-epidemiológicas e de supervivência do melanoma ocular concordam com séries internacionais. Esperamos que este estudo possa ajudar para melhorar o conhecimento da doença e das opções terapêuticas disponíveis na região.
Palavras chave: melanoma ocular, enucleação, sobrevida.
INTRODUCCIÓN
El melanoma ocular representa la neoplasia orbitaria más frecuente en adultos en Uruguay; los datos de la Comisión Honoraria de Lucha contra el Cáncer reflejan una incidencia de melanoma no cutáneo de 0.35 por cada 100.000 habitantes1.Dada la poca frecuencia de esta patología y las diferentes opciones de tratamiento de acuerdo al estadio, se realizará inicialmente una revisión sobre los aspectos relevantes de la enfermedad y posteriormente explicaremos los objetivos de nuestro trabajo.
Conceptos generales
Esta patología puede localizarse en úvea (iris, cuerpo ciliar o coroides) o conjuntiva y, aunque comparten un origen embrionario común, difieren en las características clínico-epidemiológicas, pronóstico y tratamiento. La forma de presentación uveal es la más habitual y representa el 3% al 5% de todos los melanomas, con una tasa de incidencia estimada de 5.2 casos por millón de habitantes por año en los Estados Unidos; la edad media de presentación es de 62 años2. El melanoma de conjuntiva es aún menos frecuente, con una incidencia de 0,2-0,5 casos por millón de habitantes por año y un pico en mayores de 40 años3.
Factores predisponentes y genética
Globalmente afecta predominantemente a la raza blanca, sin diferencias en cuanto a la distribución por sexo4. Los factores de riesgo que se han relacionado con el melanoma ocular son: el color claro de la piel, el cabello rubio, el iris azul o claro, el síndrome de nevus displásico, neurofibromatosis tipo 1 y la melanocitosis oculodérmica5-6. El papel de la luz solar es incierto. En cuanto al riesgo por antecedente familiar, algunos casos han sido descritos en la literatura y apuntan a una transmisión autosómica dominante, asociada a la línea germinal BAP1 (que codifica para el gen BRCA1)7. Esta mutación se asocia con tumores grandes, afectación al cuerpo ciliar y progresión a un fenotipo metastásico agresivo8. Presentan tempranamente alteraciones cromosómicas como monosomía 3, ganancia del cromosoma 6p o mutaciones en GNAQ o GNA11 que parecen activar la vía MAPK; la mutación BRAF es rara en este grupo de pacientes9-11.
Clínica y diseminación
Los síntomas de presentación dependerán del tamaño y la ubicación del tumor, generalmente la disminución o pérdida de la agudeza visual es el síntoma más frecuente y está relacionado con la afectación tumoral de la mácula o desprendimiento de retina12. El melanoma uveal se disemina por vía hemática principalmente al hígado, aunque no se conoce con certeza la causa de esta predilección. Otros sitios de metástasis incluyen hueso, médula ósea, pulmón, SNC, entre otros.
Clasificación general
Se clasifican considerando criterios citológicos e histológicos. Callender en 1931 los dividió en: fusocelulares (subtipo A y B), epitelioides, mixtos, fasciculares y necróticos13-14. El melanoma fusocelular se presenta con un bajo conteo mitótico y un mejor pronóstico, mientras que los epitelioides se asocian con una alta tasa de mitosis y mal pronóstico14. También se han establecido clasificaciones según de su localización y tamaño. El melanoma uveal posterior (cuerpo ciliar y coroides) se clasifica —de acuerdo con el Collaborative Ocular Melanoma Study (COMS)— según el tamaño tumoral en pequeños (cuando miden 1.0-2.4 mm de alto y/o 4 a 8 mm de diámetro), medianos (cuando miden de 2.5 a 10 mm de altura y/o 6 a 16 mm de diámetro) y grandes (cuando son mayores a 10 mm de altura y/o mayores a 16 mm de diámetro), y el pronóstico es variable de acuerdo con el tamaño15. Cuando presentan más de 2 mm de grosor la mortalidad ronda en el 10%, y cuando es de 6 mm de espesor alcanza el 30%, cada aumento de milímetro de espesor añade aproximadamente un 5% al riesgo de desarrollar metástasis16.
Las características clínicas asociadas con un mal pronóstico en el melanoma uveal son: edad avanzada, sexo masculino, mayor diámetro basal y grosor del tumor, localización en cuerpo ciliar, extensión extraocular y estadificación tumoral avanzada según la clasificación del American Joint Committee on Cancer17. Las características histopatológicas que sugieren un mal pronóstico incluyen el tipo de células epitelioides y alta actividad mitótica.
Melanoma de iris: representa el 3% de todos los melanomas de la úvea y es frecuente su debut como una tumoración de pigmentación variable, circunscrita o difusa en la superficie del iris18; para el diagnóstico se utiliza la lámpara de hendidura, gonioscopía y ultrasonido. Es importante controlar el crecimiento de la lesión ya que puede invadir el ángulo de la cámara anterior, provocando hipertensión ocular o hemorragias. En cuanto a la clasificación del melanoma de iris se considera tamaño y compromiso de otras estructuras, como cuerpo ciliar, coroides o ambos con o sin extensión extraescleral17. El tratamiento más habitual es resección quirúrgica con un margen de seguridad y luego se puede aplicar braquiterapia epiescleral según el caso para evitar recurrencias en los bordes quirúrgicos9.
Melanoma conjuntival: tiende a presentarse como área pigmentada sobreelevada de color café, negruzco, amarillento o amelanótico. Sin otra sintomatología asociada, con mayor frecuencia presenta metástasis por vía linfática, también se asocia a mayor morbilidad y mortalidad. La clasificación de melanoma conjuntival dependerá de su localización en la conjuntiva20-21, bulbar o no bulbar (fórnix, palpebral, tarsal) si involucra o no la carúncula y su extensión a conductos lacrimales o sacos lagrimales, senos paranasales o sistema nervioso central. Se asocian a mal pronóstico el grosor mayor de 1 a 2 mm y la localización extralímbica del tumor (carúncula, fondos de saco y conjuntiva palpebral)18.
Opciones terapéuticas
Las opciones de manejo dependen del caso en particular (localización, tamaño y extensión local). Dentro de las modalidades terapéuticas para el melanoma conjuntival localizado el tratamiento de elección es la resección quirúrgica y en algunos casos se pueden utilizar terapias adyuvantes como mitomicina C e interferón con buenos resultados21. En cuanto al tratamiento del melanoma uveal se cuenta con la enucleación, braquiterapia, radioterapia con haz de partículas cargadas o radioterapia basada en fotones, termoterapia transpupilar, fotocoagulación con láser y radiocirugía estereotáctica de rayos gamma22. En cuanto al estadio metastásico, están en curso ensayos con inmunoterapia de los cuales aún se aguardan sus resultados23-24. También se ha probado quimioterapia, bevacizumab, inhibidores de tirosin kinasa, inhibidores MEK, pero no han mostrado evidencia en prolongar la sobrevida. El panorama en la enfermedad metastásica sigue siendo sombrío, con una supervivencia media que varía entre 2 y 12 meses25-26.
Por lo explicado anteriormente, teniendo en cuenta su potencial mortalidad, los pocos trabajos de sobrevida en la región y la falta de tratamientos eficaces ante la recaída de la enfermedad, se propone como objetivo del presente estudio determinar las características clínico-epidemiológicas, manejo terapéutico y la tasa de supervivencia a los 20 años en pacientes con diagnóstico de melanoma ocular, en el Hospital Universitario de la ciudad de Montevideo, República Oriental del Uruguay.
MATERIALES Y MÉTODOS
Diseño de estudio. Se realizó un estudio retrospectivo, de tipo cohortes históricas, donde se revisó en la base de datos de programa HCEO (historia clínica electrónica oncológica) implementada desde 2015, y las historias clínicas físicas de los pacientes con diagnóstico de melanoma ocular que se trataron y controlaron en el servicio de oftalmología y oncología médica del Hospital de Clínicas Dr. Manuel Quintela (Montevideo,
Uruguay) en un período de 20 años (1997 a 2017).
Criterios de inclusión/exclusión. Se incluyó la totalidad de pacientes con diagnóstico de melanoma ocular durante el período del estudio y se excluyeron aquellos pacientes con sospecha de la enfermedad que no contaban con confirmación histológica, así como resultados no concluyentes o diagnosticados fuera del período de tiempo estimado.
Parámetros evaluados. Se estudiaron las siguientes variables: edad, sexo, motivo de consulta, localización, histología, estadio de la enfermedad al debut, tratamiento regional recibido, presencia o no de metástasis, tiempo hasta la progresión, métodos de imágenes que se utilizaron para diagnosticar/estadificar, y también si estaba vivo o fallecido al momento de finalizar el trabajo. Para la estadificación se utilizó la última actualización del AJCC, octava edición18.
Evaluación estadística. Los resultados de las variables se expresaron con medidas de tendencia central (media, mediana y moda). Las proporciones se expresaron en frecuencia absoluta y frecuencia relativa. El análisis estadístico se realizó con el programa Microsoft Office Excel 2010. Para los cálculos de los intervalos de confianza del 95%, del valor de p y cálculos de sobrevida se utilizó el programa IBM SPSS versión 24. Se consideró estadísticamente significativo un valor de p <0,05. Para el cálculo de sobrevida se usó el método de Kaplan Meier.
RESULTADOS
La cohorte quedó conformada por 24 pacientes, la media de edad fue de 58 años al momento del diagnóstico (rango: 30 a 76 años), la distribución por sexo fue 17 mujeres (70.8%) y 7 hombres (29.2%). Cuatro casos presentaron alteraciones oculares preexistentes como: estrabismo, nevus congénitos y/o catarata congénita. El motivo de consulta más frecuente fue la pérdida de la visión presente en 21 casos (88%), dolor en nueve casos (38%), hallazgo accidental en el fondo de ojo (masa pigmentada, irregular, sobreelevada) en 5 casos (21%) y otros síntomas como diplopía (8%), adenopatías (4%), secreción ocular (4%), prurito (4%) o lesiones oculares conjuntivales que se presentaron en la minoría de pacientes.
Las características de la población estudiada se describen en la tabla 1, donde se observa que el 79% de los casos se presentó en el ojo izquierdo, y en cuanto a su localización, el melanoma de coroides fue el más frecuente, 15 casos (62,5%), seguido de cuerpo ciliar (6 casos); conjuntival (2 casos) y de iris (1 caso). La histología fue epitelioide en 9 casos (37,5%), mixto en 7 casos (29,2%), y fusocelular en 8 casos (33,3%). Dieciséis casos tenían un conteo mitótico alto y factores de mal pronóstico como necrosis en 10 casos (41%), invasión escleral en 7 casos (29,1%), invasión lcal en 4 casos, invasión linfovascular en 5 casos e infiltración del nervio óptico en 2 casos.
Tabla 1. Características clínicas de los pacientes.
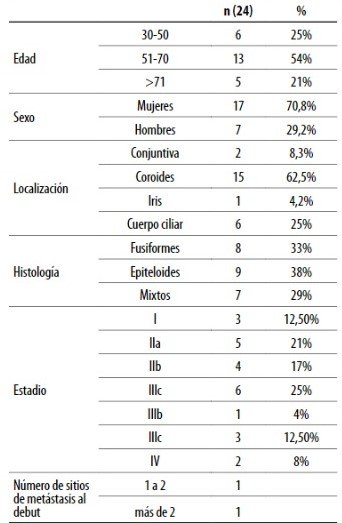
Acorde con la nueva estadificación de la AJCC17 se presentaron en estadio I 3 casos, estadio IIa 5 casos, estadio IIb 4 casos, estadio IIIa 5 casos, IIIb 1 caso, IIIc 4 casos, IV al debut 2 casos. A todos los pacientes se los estudió con fondo de ojo y ecografía ocular; la estadificación de estadios avanzados se realizó con tomografía computarizada o resonancia magnética, en 3 casos para evaluar la extensión local se realizó con resonancia magnética de órbitas. En 2 casos con dudas diagnósticas se solicitó PET/TC.
El tratamiento y la evolución se describen en la tabla 2: se realizó enucleación en 19 casos (79%), en el paciente con melanoma de iris se realizó iridectomía más facoemulsificación con colocación de lente intraocular; al primer caso de melanoma conjuntival se le realizó exéresis del tumor conjuntival y en el otro caso se realizó quimioterapia neoadyuvante en base al plan Dartmouth (dacarbazina, carmustina, tamoxifeno y cisplatino) con posterior enucleación; dado que se constató progresión bajo tratamiento, recibió radioterapia paliativa (dosis de 5.200 cGy) en el lecho, junto con quimioterapia sistémica (dacarbazina).
Tabla 2. Características del tratamiento y evolución
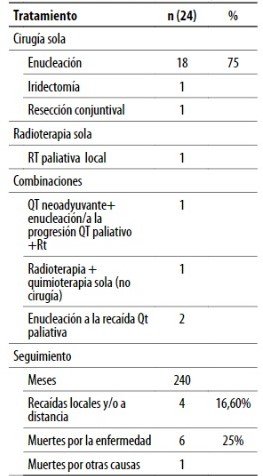
Durante el seguimiento de 240 meses, 17 (70,8%) pacientes se encuentran vivos y en controles, 2 pacientes fallecieron por enfermedad metastásica (hígado y SNC), 4 progresaron y murieron por la enfermedad (diseminación a hígado, cerebro, pulmón, peritoneo y óseo) y uno por otras causas. En cuanto a la sobrevida, el evento muerte ocurrió en pocos casos, por lo que la mediana no fue alcanzada. La tasa de supervivencia a los 5 años es del 74,2% y a los 10 años del 51,9%. Cuando se comparó la sobrevida global de acuerdo con el tipo histológico, se observó que los pacientes con histología epitelioide alcanzaron una mediana de sobrevida global de 105 meses IC 95% (25,7-208,2) y la probabilidad de supervivencia a los 5 años fue de 54%. Las otras histologías (fusocelular y mixto) no alcanzaron la mediana de sobrevida global, pero la tasa de supervivencia para ambas histologías fue de 70% a los 5 años (figs. 1 y 2). La mediana de sobrevida global para el conjunto de pacientes en estadio IIIc y IV que progresaron o recayeron fue de 4 meses (IC 95% 0,080-7,920). Cuando se analizaron por separado, en el estadio IIIc la media de sobrevida global fue 6 meses y 2 meses para el estadio IV (fig. 3).

Figura 1. Curva de sobrevida de los pacientes con melanoma ocular (tiempo evaluado en meses).

Figura 2. Curva de sobrevida según histología (tiempo evaluado en meses).
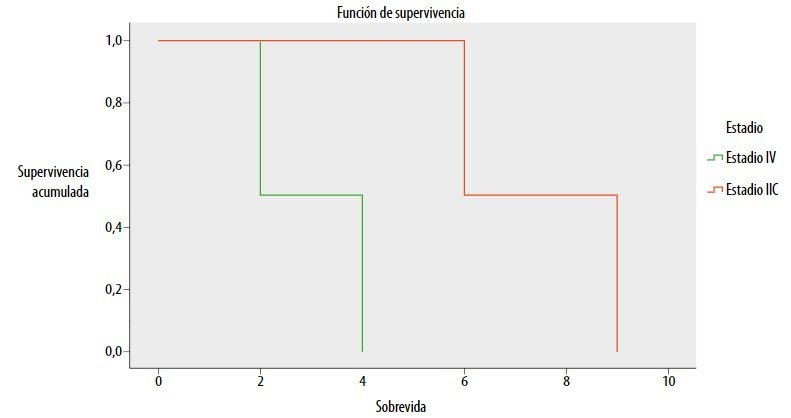
Figura 3. Curva de sobrevida según estadio de la enfermedad (tiempo evaluado en meses).
DISCUSIÓN
El melanoma ocular puede presentarse en la conjuntiva, iris, cuerpo ciliar y coroides. Hasta la fecha no se han informado estudios de sobrevida de pacientes con melanoma ocular en Uruguay, lo que motivó el desarrollo de este estudio. En nuestra cohorte, la localización uveal posterior representó el 84,5% de los casos, la edad media de debut fue 58 años y predominó en pacientes de raza blanca. Estos datos son acordes con las características epidemiológicas de series internacionales (SEER 1973-2008)2; en las guías clínicas de Reino Unido el debut en la localización posterior es el 96% de todos los melanomas uveales27. Si bien en nuestro estudio tuvo una mayor preponderancia en el sexo femenino, esto no es confirmado en otras series. La presentación en el iris es menos común y tiene un curso clínico más benigno17, lo que se confirma en este reporte, donde el único caso de melanoma de iris se mantiene vivo a la fecha (133 meses desde el diagnóstico). Al igual que lo informado en otras series, los síntomas más frecuentes de la localización uveal fueron: disminución de la visión 63,5% y dolor 29% que, junto con el examen de fondo de ojo realizado por un oftalmólogo con experiencia en tumores oculares, sirven para diagnosticar con precisión el melanoma ocular. Típicamente en el fondo de ojo los melanomas aparecen como masas pigmentadas o con forma de domo o botón de camisa. En el COMS report número 13 y 29 se confirmó la utilidad de la ecografía de modo B para evaluar la forma, el tamaño y planificar la intervención terapéutica28-30. El fondo de ojo combinado con la ecografía sirven para establecer el diagnóstico en más del 95% de los casos y es muy rara la necesidad de efectuar una biopsia30-32. En nuestra serie sólo un caso requirió confirmación histológica dado su debut como secundarismo con tumor primitivo oculto. Otros exámenes de estadificación que se solicitan individualizando los casos son TC/RMN de órbitas, angiografía con fluoresceína, PET/TC. Estos estudios se indicaron y realizaron según las pautas de la Sociedad Americana de Oftalmología y las Pautas Nacionales de Oncología Médica en su totalidad33.
Se ha descrito que los tumores que involucran el cuerpo ciliar tienen mayor probabilidad de metástasis21, 14 y mal pronóstico; esto se evidenció en este estudio, ya que de los tumores de esa localización, un caso (16,6%) debutó con presencia de metástasis y dos (33,3%) recayeron durante su evolución. Según lo publicado por Berus y colaboradores también se confirmó que el melanoma de histología epitelioide tiene un comportamiento más agresivo que el fusiforme22, dando mayor porcentaje de recaídas, metástasis, una menor sobrevida global y una probabilidad de supervivencia a 5 años del 54%. Estos resultados lo atribuimos a la agresividad informada para este tipo histológico que ocasiona que la gran mayoría de los tumores que presentaron esta estirpe histológica debutaran como estadio III y IV.
En la actualidad se pueden considerar diversas opciones terapéuticas. Los tumores coroideos pequeños y los medianos se tratan principalmente con radioterapia (braquiterapia, terapia con haz de protones o radioterapia estereotáxica). Un ensayo publicado en 2011 por el grupo COMS que estudió 1.317 pacientes no halló diferencia significativa en la mortalidad entre braquiterapia con yodo 125 comparado con la enucleación34.
Si bien la braquiterapia se usa ampliamente en la actualidad, las complicaciones asociadas a la técnica incluyen retinopatía inducida por radiación, cataratas, glaucoma neovascular y edema macular, que pueden desarrollarse hasta 5 años después del tratamiento35. Esta técnica es preferida para los tumores que rodean el disco óptico y la fóvea, ya que demostró un mejor control local, preservación ocular y supervivencia libre de enfermedad34, 36.
Otra técnica que se desarrolló en las últimas cuatro décadas es la radioterapia con partículas cargadas (haces de protones) que se usa predominantemente para los melanomas coroideos y de cuerpo ciliar. Se prefiere en aquellos que no involucran el disco óptico o la fóvea y se usa tanto como tratamiento primario, terapia de rescate para la recurrencia o neoadyuvante antes de la resección quirúrgica37-38. Cuando se compara el tratamiento de braquiterapia con la enucleación, ambas presentan tasas de recurrencia y mortalidad bajas39-40. La decisión de utilizar la braquiterapia o la terapia con haz de protones depende del tamaño, la ubicación del tumor y los deseos del paciente. En cuanto a las técnicas de radioterapia descritas, dada la falta de disponibilidad de estos tratamientos en Uruguay, los que podrían haber sido candidatos no pudieron optar por algunas de estas opciones por lo que la enucleación fue el tratamiento de elección en el 75% de los casos.
Para tumores pequeños también se pueden utilizar otras opciones de tratamiento como la termoterapia transpupilar, fotocoagulación, terapia fotodinámica y resección local41-42. Dentro de nuestro protocolo hospitalario las indicaciones para realizar la enucleación ocular son: ojo ciego y doloroso, tumores que ocupan más de 50% del globo ocular, tumores con invasión extraescleral o fracaso de otras técnicas. Además, hay que tener en cuenta que, tanto la radioterapia en sus diversas variantes y la enucleación como tratamiento en estadios precoces, muestran resultados similares en cuanto a sobrevida. Sin embargo, en algunos centros la radioterapia es de elección porque permite conservar el globo ocular43. La terapia sistémica neoadyuvante o adyuvante no ha demostrado utilidad en pacientes con melanoma uveal primario y ninguna terapia ha demostrado reducir el riesgo de metástasis o incrementar la sobrevida global44.
Singh y colaboradores, a través de SEER del Instituto Nacional del Cáncer de Estados Unidos, publicaron uno de los estudios de sobrevida con mayor número de pacientes (4.070) y en cuanto a supervivencia concluyó que los datos se han mantenido estables durante los últimos treinta años (1973-2008), independiente del tratamiento realizado las tasas relativas de supervivencia a 5 años variaron del 77% al 84% sin una variación estadísticamente significativa45. Cuando se revisan otras series internacionales publicadas, la supervivencia relativa no presenta grandes diferencias. En Europa en la serie publicada por Virgili, la supervivencia relativa a cinco años fue del 68,9%46. En Suecia, una serie de 2.997 casos tuvo una tasa de supervivencia relativa del 70,1%47, y una serie española de 500 pacientes fue la que reportó la más alta supervivencia específica por melanoma con una media de 207 meses y una probabilidad de supervivencia a los 5 años de 87,7%48.
Al finalizar este estudio la mayoría de los pacientes se encontraban vivos; la mediana de sobrevida global no fue alcanzada y la tasa de supervivencia a 5 años fue de 74%, lo que concuerda con las series internacionales (fig. 1). En el entorno metastásico los tratamientos que se han estudiado incluyen quimioterapia sistémica, inmunoterapia (nivolumab, ipilimumab, pembrolizumab)23-24, 49, agentes dirigidos contra la vía MAPK y terapias dirigidas al hígado, pero las tasas de respuesta generalmente son inferiores al 10% y no se ha demostrado que ninguna incremente la sobrevida global50. El inhibidor de MEK, selumetinib, prolongó significativamente la sobrevida libre de progresión y aumentó la tasa de respuesta en un estudio fase II51 pero desafortunadamente en el estudio fase III, cuando se comparó asociado a dacarbazina versus dacarbazina sola, la mediana de sobrevida libre de progresión no mejoró significativamente en el grupo que recibió la combinación52-53.
En los ensayos COMS los pacientes estadio IV tuvieron una sobrevida media entre 2 y 12 meses, y en 46% de los pacientes el principal sitio de metástasis fue el hígado54. En nuestra cohorte, aquellos pacientes que desarrollaron metástasis también fallecieron en un tiempo corto, menor a 10 meses, independientemente del tratamiento recibido. En los pacientes estadios IIIc y IV que debutaron o recayeron, la mediana de sobrevida global fue de 4 meses, lo que confirma que ningún tratamiento ante la progresión o el debut con metástasis resulta efectivo en alargar la sobrevida.
En cuanto a procedimientos locales, la resección de lesiones hepáticas se realiza en casos muy seleccionados ya que puede ofrecer un aumento de la sobrevida a largo plazo55. La ablación por radiofrecuencia, quimioembolización, infusión intraarterial hepática y perfusión hepática aislada (IHP) son otros enfoques dirigidos a tratar las metástasis hepáticas que se puede considerar en cada paciente al individualizar los riesgos y beneficios; sin embargo, con estas técnicas la utilidad de sobrevida global y sobrevida libre de progresión son modestos56-58. Los pacientes del reporte no fueron candidatos para optar por alguna de estas técnicas, por lo que no se realizaron.
Es importante mantener los controles oftalmológicos y oncológicos periódicos, sabiendo que la aparición de metástasis puede retrasarse durante años y aproximadamente el 50% de los pacientes pueden desarrollar enfermedad metastásica dentro de los 15 años posteriores al diagnóstico59.
CONCLUSIONES
A partir de los resultados encontrados se concluye que las características clínico epidemiológicas y de sobrevida del melanoma ocular en Uruguay concuerdan con series internacionales. Los autores del presente trabajo desean que estos datos puedan ayudar a mejorar el conocimiento de la enfermedad junto con las opciones terapéuticas disponibles en la región.
REFERENCIAS
- Barrios E, Garau M, Alonso R, Musetti C. IV Atlas de incidencia del cáncer en Uruguay 20072011. Montevideo: Comisión Honoraria de Lucha contra el Cáncer, 2014, p. 114-115.
- Aronow ME, Topham AK, Singh AD. Uveal melanoma: 5-year update on incidence, treatment, and survival (SEER 1973-2013). Ocul Oncol Pathol 2018; 4: 145-51.
- Yu G, Hu D, McCormick S, Finger PT. Conjunctival melanoma: is it increasing in the United States? Am J Ophthalmol 2003; 135: 800-6.
- Damato BE, Coupland SE. Differences in uveal melanomas between men and women from the British Isles. Eye (Lond) 2012; 26: 292-9.
- Rodríguez A, Dueñas-Gonzales A, Delgado-Pelayo S. Clinical presentation and management of uveal melanoma. Mol Clin Oncol 2016; 5: 675-7.
- Sumich P, Mitchell P, Wang JJ. Choroidal nevi in a white population: the Blue Mountains Eye Study. Arch Ophthalmol 1998; 116: 645-50.
- Krygier G, Lombardo K, Vargas C et al. Familial uveal melanoma: report on three sibling cases. Br J Ophthalmol 2001; 85: 1007-8.
- Gupta MP, Lane AM, DeAngelis MM et al. Clinical characteristics of uveal melanoma in patients with germline BAP1 mutations. JAMA Ophthalmol 2015; 133: 881-7.
- Tschentscher F, Hüsing J, Hölter T et al. Tumor classification based on gene expression profiling shows that uveal melanomas with and without monosomy 3 represent two distinct entities. Cancer Res 2003; 63: 2578-84.
- Dono M, Angelini G, Cecconi M et al. Mutation frequencies of GNAQ, GNA11, BAP1, SF3B1, EIF1AX and TERT in uveal melanoma: detection of an activating mutation in the TERT gene promoter in a single case of uveal melanoma. Br J Cancer 2014; 110: 1058-65. 11.
- Rimoldi D, Salvi S, Liénard D et al. Lack
of BRAF mutations in uveal melanoma. Cancer Res 2003; 63: 5712-5.
- Yonekawa Y, Kim IK. Epidemiology and management of uveal melanoma. Hematol Oncol Clin North Am 2012; 26: 1169-84.
- McLean IW, Saraiva V, Burnier MN Jr. Pathological and prognostic features of uveal melanomas. Can J Ophthalmol 2004; 39: 343-50.
- Krygier G. Melanoma intraocular: opciones terapéuticas y evolución de 30 pacientes. Rev Med Uruguay 1994; 10: 165-173.
- Collaborative Ocular Melanoma Study Group. Comparison of clinical, echographic, and histopathological measurements from eyes with medium-sized choroidal melanoma in the collaborative ocular melanoma study: COMS report no. 21. Arch Ophthalmol 2003; 121: 1163-71.
- Shields CL, Kaliki S, Furuta M et al. American Joint Committee on Cancer classification of posterior uveal melanoma (tumor size category) predicts prognosis in 7731 patients. Ophthalmology 2013; 120: 2066-71.
- Amin MB, Edge S, Greene F et al. AJCC cancer staging manual. 8th ed. Chicago: American Joint Committee on Cancer; Springer, 2017, p. 163-983.
- Khan S, Figer PT, Yu GP et al. Clinical and pathologic characteristics of biopsy-proven iris melanoma: a multicenter international study. Arch Ophthalmol 2012; 130: 57-64.
- Conway RM, Chua WC, Qureshi C et al. Primary iris melanoma: diagnostic features and outcome of conservative surgical treatment. Br J Ophthalmol 2001; 85: 848-54.
- Shields CL, Shields JA, Gündüz K et al. Conjunctival melanoma: risk factors for recurrence, exenteration, metastasis, and death in 150 consecutive patients. Arch Ophthalmol 2000; 118:1497-507.
- Blum ES, Yang J, Komatsubara KM et al. Clinical management of uveal and conjunctival melanoma. Oncology (Williston Park) 2016; 30: 29-32, 34-43, 48.
- Berus T , Halon A, Markiewicz A et al. Clinical, histopathological and cytogenetic prognosticators in uveal melanoma: a comprehensive review. Anticancer Res 2017; 37: 6541-49.
- Algazi AP, Tsai KK, Shoushtari AN et al. Clinical outcomes in metastatic uveal melanoma treated with PD-1 and PD-L1 antibodies. Cancer 2016; 122: 3344-53.
- Zimmer L, Vaubel J, Mohr P et al. Phase II DeCOG-study of ipilimumab in pretreated and treatment-naïve patients with metastatic uveal melanoma. PLoS One 2015; 10: e0118564.
- Rietschel P, Panageas KS, Hanlon C et al. Variates of survival in metastatic uveal melanoma. J Clin Oncol 2005; 23: 8076-80.
- Rao YJ, Sein J, Badiyan S et al. Patterns of care and survival outcomes after treatment for uveal melanoma in the post-coms era (2004-2013): a surveillance, epidemiology, and end results analysis. J Contemp Brachytherapy 2017; 9: 453-65.
- Nathan P, Cohen V, Coupland S et al. Uveal melanoma UK national guidelines. Eur J Cancer 2015; 51: 2404-12.
- Eskelin S, Kivelä T. Mode of presentation and time to treatment of uveal melanoma in Finland. Br J Ophthalmol 2002; 86: 333-8.
- Byrne SF, Marsh MJ, Boldt HC et al. Consistency of observations from echograms made centrally in the Collaborative Ocular Melanoma Study COMS Report no. 13. Ophthalmic Epidemiol 2002; 9: 11-27.
- Boldt HC, Byrne SF, Gilson MM et al. Collaborative Ocular Melanoma Study Group. Baseline echographic characteristics of tumors in eyes of patients enrolled in the Collaborative Ocular Melanoma Study: COMS report no. 29. Ophthalmology 2008; 115: 1390-7.
- Echography (ultrasound) procedures for the Collaborative Ocular Melanoma Study (COMS), Report no. 12, Part I. J Ophthalmic Nurs Technol 1999; 18: 143-9.
- Accuracy of diagnosis of choroidal melanomas in the Collaborative Ocular Melanoma Study. COMS report no. 1. Arch Ophthalmol 1990; 108: 1268-73.
- Pautado de Oncología Médica. Cátedra de Oncología Médica, Hospital de Clínicas, Montevideo, 2016.
- Hawkins BS. Collaborative ocular melanoma study randomized trial of I-125 brachytherapy. Clin Trials 2011; 8: 661-73.
- Peddada K, Sangani R, Verma V et al. Complications and adverse events of plaque brachytherapy for ocular melanoma. J Contemp Brachytherapy 2019; 11: 392-397.
- Diener-West M, Earle JD, Fine SL et al. Collaborative Ocular Melanoma Study Group. The COMS randomized trial of iodine 125 brachytherapy for choroidal melanoma, III: initial mortality findings. Arch Ophthalmol 2001; 119: 969-82.
- Damato B, Kacperek A, Errington D et al. Proton beam radiotherapy of uveal melanoma. Saudi J Ophthalmol 2013; 27:151-7.
- Riechardt AI, Cordini D, Dobner B et al. Salvage proton beam therapy in local recurrent uveal melanoma. Am J Ophthalmol 2014; 158: 948-56.
- Wang Z, Nabhan M, Schild SE et al. Charged particle radiation therapy for uveal melanoma: a systematic review and meta-analysis. Int J Radiat Oncol Biol Phys 2013; 86: 18-26. 40.
- Papakostas TD, Lane AM, Morrison M et al. Long-term outcomes after proton beam irradiation in patients with large choroidal melanomas. JAMA Ophthalmol 2017; 135: 1191-6.
- Seddon JM, Gragoudas ES, Egan KM et al. Relative survival rates after alternative therapies for uveal melanoma. Ophthalmology 1990; 97: 769-77.
- Yang J, Manson DK, Marr BP et al. Treatment of uveal melanoma: ¿where are we now? Ther Adv Med Oncol 2018; 10: 1758834018757175.
- Seddon JM, Gragoudas ES, Albert DM. Comparison of survival rates for patients with uveal melanoma after treatment with proton beam irradiation or enucleation. Am J Ophthalmol 1985; 99: 282-90.
- Choudhary MM, Triozzi PL, Singh AD. Uveal melanoma: evidence for adjuvant therapy. Int Ophthalmol Clin 2015; 55: 45-51.
- Singh AD, Topham A. Survival rates with uveal melanoma in the United States: 19731997. Ophthalmology 2003; 110: 962-5.
- Virgili G, Gatta G, Ciccolallo L et al. Survival in patients with uveal melanoma in Europe. Arch Ophthalmol 2008; 126: 1413-8.
- Bergman L, Seregard S, Nilsson B et al. Uveal melanoma survival in Sweden from 1960 to 1998. Invest Ophthalmol Vis Sci. 2003; 44: 3282-7.
- Alonso Martinez P. Estudio de supervivencia en pacientes con melanoma uveal de una unidad de referencia de tumores intraoculares. Valladolid, 2013. Tesis doctoral. Universidad de Valladolid. Facultad de Medicina.
- Piulats Rodriguez J, Ochoa de Olza M, Codes M et al. Phase II study evaluating ipilimumab as a single agent in the first-line treatment of adult patients (Pts) with metastatic uveal melanoma (MUM): The GEM-1 trial. J Clin Oncol 2014; 32: 15 suppl. 9033.
- Augsburger JJ, Corrêa ZM, Shaikh AH. Effectiveness of treatments for metastatic uveal melanoma. Am J Ophthalmol 2009; 148: 119-27.
- Carvajal RD, Sosman JA, Quevedo JF et al. Effect of selumetinib vs chemotherapy on progression-free survival in uveal melanoma: a randomized clinical trial. JAMA 2014; 311: 2397-405. 52.
- Carvajal RD, Schwartz GK, Mann H et al. Study design and rationale for a randomised, placebo-controlled, double-blind study to assess the efficacy of selumetinib (AZD6244; ARRY142886) in combination with dacarbazine in patient with metastatic uveal melanoma (SUMIT). BMC Cancer 2015; 15: 467.
- Carvajal RD, Piperno-Neumann S, Kapiteijn E et al. Selumetinib in combination with dacarbazine in patients with metastatic uveal melanoma: a phase III, multicenter, randomized trial (SUMIT). J Clin Oncol 2018; 36: 1232-9.
- Diener-West M, Reynolds SM, Agugliaro DJ et al. Development of metastatic disease after enrollment in the COMS trials for treatment of choroidal melanoma: Collaborative Ocular Melanoma Study Group report no 26. Arch Ophthalmol 2005; 123: 1639-43.
- Agarwala SS, Eggermont AM, O’Day S, Zager JS. Metastatic melanoma to the liver: a contemporary and comprehensive review of surgical, systemic, and regional therapeutic options. Cancer 2014; 120: 781-9.
- Leyvraz S, Piperno-Neumann S, Suciu S et al. Hepatic intra-arterial versus intravenous fotemustine in patients with liver metastases from uveal melanoma (EORTC 18021): a multicentric randomized trial. Ann Oncol 2014; 25: 742-6.
- Sharma KV, Gould JE, Harbour JW et al. Hepatic arterial chemoembolization for management of metastatic melanoma. AJR Am J Roentgenol 2008; 190: 99-104.
- Mariani P, Almubarak MM, Kollen M et al. Radiofrequency ablation and surgical resection of liver metastases from uveal melanoma. Eur J Surg Oncol 2016; 42: 706-12.
- Blanco PL, Lim LA, Miyamoto C, Burnier MN. Uveal melanoma dormancy: an acceptable clinical endpoint? Melanoma Res 2012; 22: 334-40.




