CASOS CLÍNICOS
Hallazgos retinales en paciente con glomerulonefritis proliferativa mesangial
Franco Malfatti, Osvaldo Bosco, Jennifer Patricia Faray, Emiliano Facundo Ross
Servicio de Oftalmología, Hospital Dr. Prof. Alejandro Posadas, El Palomar (Buenos Aires), Argentina.
Recibido: 26 de mayo de 2025.
Aprobado: 15 de julio de 2025.
Autor corresponsal
Dr. Franco Malfatti
Servicio de Oftalmología,
Hospital Dr. Prof. Alejandro Posadas
Av. Presidente Arturo U. Illia s/n y Marconi Morón 386
(B1684) El Palomar, provincia de Buenos Aires
Argentina
+54 (011) 4469-9300
fran.malfatti13@gmail.com
Oftalmol Clin Exp (ISSNe 1851-2658)
2025; 18(3): e344-e350.
DOI: https://doi.org/10.70313/2718.7446.v18.n3.434
Resumen
Objetivo: La glomerulopatía proliferativa mesangial (GPM) se caracteriza por la proliferación de las células mesangiales con acumulación de matriz mesangial extracelular. El objetivo de este artículo es describir los hallazgos retinales en el fondo de ojo de una paciente con GPM.
Caso clínico: Una paciente de 34 años concurrió para realizar control de rutina. Tenía antecedentes de asma bronquial, hipertensión arterial y GPM con depósitos de IgM que requirió trasplante renal. En su exploración se constató una agudeza visual de 10/10 en ambos ojos. Como hallazgo, en el fondo de ojo se detectaron múltiples lesiones redondeadas de menos de un cuarto de diámetro papilar en polo posterior con compromiso macular, perifoveales y en retina periférica 360°. En la tomografía de coherencia óptica se observaron alteraciones del perfil posterior compatibles con depósitos drusenoides a nivel del epitelio pigmentario retinal y múltiples imágenes hiperreflectivas por alteración del EPR a nivel de la retinofluoresceinografía. Se realizaron además estudios de campo visual que evidenciaron escotomas aislados en ambos ojos y electrorretinograma de características normales.
Conclusión: Los hallazgos retinales en la GPM brindan información sobre la afectación ocular de la glomerulopatía proliferativa mesangial y nos permiten realizar el seguimiento de estos pacientes para la detección temprana y/o prevención de sus posibles complicaciones.
Palabras clave: glomerulonefritis proliferativa mesangial, retinopatía, depósitos retinales, drusas.
Retinal findings in a patient with mesangial proliferative glomerulonephritis
Abstract
Objective: Mesangial proliferative glomerulopathy is (MPG) characterized by the proliferation of mesangial cells with extracellular matrix accumulation. The aim of this article is to describe retinal findings in the fundoscopy of a patient with MPG.
Case report: A 34-year-old female presented for a routine check-up. She had a medical history of bronchial asthma, hypertension, and MPG with IgM deposits, which required renal transplantation. On examination, her visual acuity was 10/10 in both eyes. Fundoscopy revealed multiple round lesions smaller than ¼ of the optic disc diameter in the posterior pole, affecting the macula, perifoveal areas, and 360° of the peripheral retina. Optical coherence tomography showed posterior profile alterations consistent with drusen-like deposits at the retinal pigment epithelium (RPE), and multiple hyperreflective images indicative of RPE alterations were observed in the retinofluoresceinography. Additionally, visual field studies revealed isolated scotomas in both eyes, and the electroretinogram showed normal characteristics.
Conclusion: In this case, retinal findings in MPG provide valuable information about ocular involvement in mesangial proliferative glomerulopathy and enable the monitoring of these patients for early detection and/or prevention of potential complications.
Keywords: mesangial proliferative glomerulopathy, retina, optical coherence tomography, glomerulonephritis.
Achados retinianos em paciente com glomerulonefrite proliferativa mesangial
Resumo
Objetivo: A glomerulonefrite proliferativa mesangial (GPM) é caracterizada pela proliferação de células mesangiais com acúmulo de matriz mesangial extracelular. O objetivo deste artigo é descrever os achados retinianos no fundo de olho de um paciente com GPM.
Caso clínico: Uma paciente de 34 anos apresentou-se para um check-up de rotina. Ela tinha histórico de asma brônquica, hipertensão arterial e GPM com depósitos de IgM, necessitando de transplante renal. Seu exame revelou uma acuidade visual de 10/10 em ambos os olhos. O exame de fundo revelou múltiplas lesões arredondadas medindo menos de um quarto do diâmetro papilar no polo posterior com envolvimento macular, lesões perifoveais e uma área retiniana periférica de 360°. A tomografia de coerência óptica revelou anormalidades do perfil posterior consistentes com depósitos drusenoides no nível do epitélio pigmentar da retina e múltiplas imagens hiperreflexivas devido a EPR alterado na retinofluoresceinografia. Estudos de campo visual também revelaram escotomas isolados em ambos os olhos e um eletrorretinograma normal.
Conclusão: Os achados retinianos na GPM fornecem informações sobre o envolvimento ocular na glomerulonefrite proliferativa mesangial e nos permitem monitorar esses pacientes para detecção precoce e/ou prevenção de potenciais complicações.
Palavras-chave: glomerulonefrite proliferativa mesangial, retinopatia, depósitos retinianos, drusas.
Introducción
Si bien la glomerulopatía proliferativa mesangial (GPM) no es frecuente en nuestro medio, se trata del segundo tipo más común de glomerulonefritis primaria en China según la revisión sistemática realizada por Yue Yang et al. y del primer tipo en frecuencia durante la primera década de vida en la mayoría de los países asiáticos1-2. La GPM se caracteriza por la proliferación de las células mesangiales con acumulación de matriz extracelular en el área glomerular3. El comienzo y la progresión de la enfermedad están determinados por la proliferación de las células mesangiales, mediados principalmente por el factor de crecimiento derivado de plaquetas (PDGF) y se establece de esta forma un mecanismo autocrino de proliferación4.
Estas células mesangiales anormales liberan factores proinflamatorios y de la matriz mesangial, entre ellos citoquinas, factores de crecimiento y autacoides, que conducen a la glomeruloesclerosis, la fibrosis intersticial y la enfermedad renal terminal5.
Se han reportado otros tipos de glomerulonefritis asociadas a hallazgos similares a nivel retinal como ocurre por ejemplo en la glomerulonefritis membranoproliferativa tipo II6-8, cuya composición es similar a la de los depósitos drusenoides glomerulares9.
El objetivo de este artículo es describir los hallazgos retinales en el fondo de ojo de una paciente con GPM.
Caso clínico
Paciente femenino de 34 años con antecedentes de asma bronquial, glomerulonefritis mesangial progresiva con depósitos de IgM, que requirió trasplante renal cadavérico en 2018. Actualmente en tratamiento con eritropoyetina, rapamicina, sirolimus, prednisona y ciclosporina; presenta hipoparatiroidismo posquirúrgico, dislipemia e HTA en tratamiento con atenolol y enalapril.
Consultó en nuestro servicio para realizar un control habitual. Al examen oftalmológico presentó una agudeza visual mejor corregida de 10/10 en ambos ojos (AO). La biomicroscopía evidenció queratitis punteada superficial difusa asociada a BUT disminuido y una presión intraocular de 12 mmHg en AO.
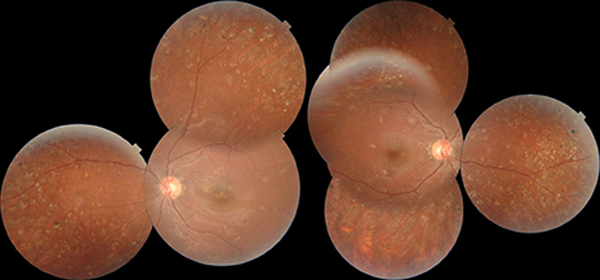
En el examen del fondo de ojos se observó una mácula de brillo conservado en AO y múltiples lesiones redondeadas de menos de un cuarto de diámetro papilar en polo posterior que comprometían a la mácula en OD, perifoveales en OI y en retina periférica 360° por fuera de las arcadas vasculares de AO, sin otros hallazgos relevantes (fig. 1).
Ante estos hallazgos se continuó la evaluación con OCT que evidenció un perfil anterior macular conservado y una alteración del perfil posterior compatible con depósitos drusenoides a nivel del EPR (fig. 2) con mínima acumulación de líquido a nivel sub-EPR.
Se realizó una retinofluoresceinografía que no mostró extravasación de líquido, isquemia, ni alteraciones vasculares en tiempos tempranos ni tardíos. Se pudieron observar imágenes de hiperreflectividad debido a alteraciones del EPR (efecto ventana) (fig. 3). El electrorretinograma presentó respuesta evocada retinal de morfología y latencias adecuadas dentro de límites fisiológicos.
Se realizaron campo visuales computarizados con protocolo 24-2 que resultaron confiables, los que evidenciaron escotomas aislados en hemicampo nasal en AO y temporal en OD con disminución generalizada de la sensibilidad en AO. El protocolo 10-2 mostró escotomas aislados centrales en AO y en hemicampo superior OD e inferior en OI con disminución generalizada de la sensibilidad.
Finalmente, luego de ser evaluado de forma exhaustiva por el servicio de retina se decidió conducta expectante y control periódico clínico y con estudios complementarios pertinentes.

Figura 1. Fundus OCT ojo izquierdo y derecho respectivamente.
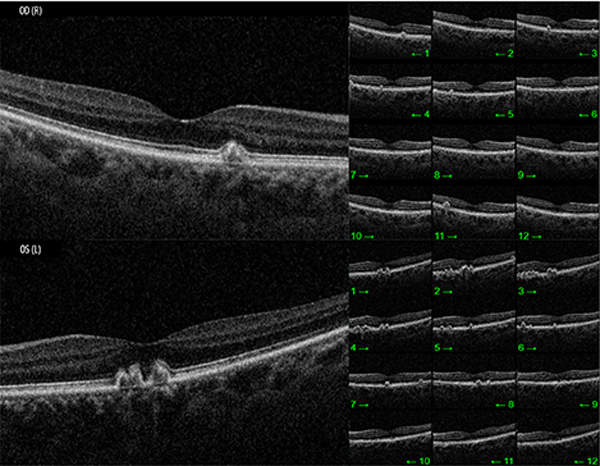
Figura 2. OCT macular de ojos derecho e izquierdo.
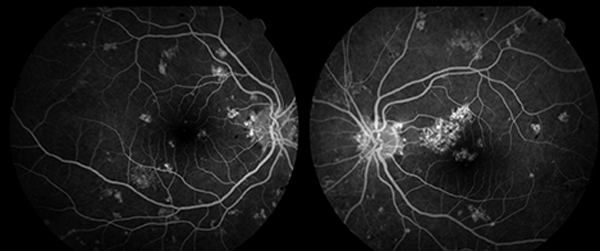
Figura 2. RFG ojos izquierdo y derecho.
Discusión
La glomerulonefritis mesangial progresiva se caracteriza —como se mencionó previamente— por la proliferación de las células mesangiales y acumulación de matriz mesangial extracelular, todo esto acompañado de un proceso inflamatorio que favorece el desarrollo de esta glomerulopatía para la cual no existe un tratamiento específico3,10, lo que conduce finalmente a su esclerosis11. Se clasifica según si el depósito es o no de IgA. En el caso presentado se trata de este último tipo.
A pesar de ser una de las causas más frecuentes de falla renal en múltiples países existe un desconocimiento actual de la fisiopatogenia completa de la glomerulonefritis mesangial proliferativa12-13, pero se sugiere un origen autoinmunitario al igual que los otros tipos de glomerulonefritis con el consecuente aumento de las células y la matriz mesangial14-15.
Actualmente existen algunos tratamientos, si bien no específicos, orientados a disminuir la inflamación, proliferación de células mesangiales y depósito de matriz lo que retarda la progresión de la glomerulonefritis16-17.
En nuestra paciente se puede observar la presencia de depósitos de tipo drusenoides a nivel del epitelio pigmentario retinal. Este tipo de depósitos ya han sido informados en pacientes con afectación renal como glomerulonefritis mesangiocapilar (tipo II) descritas por Duvall Young18-19; como así también en las glomerulonefritis membranoproliferativas7,20.
Las drusas se presentan mayormente como el estadio inicial de la degeneración macular relacionada a la edad21 y son un hallazgo poco frecuente en pacientes menores de 50 años. Estas últimas pueden clasificarse en drusas laminares basales y malattia leventinese22.
Las laminares basales son pequeñas lesiones halladas en mácula y media periferia, amarillentas, redondas y dispersas23 visualizadas en la RFG como “estrellas en el cielo” y suelen asociarse a la glomerulonefritis membranoproliferativa24.
Por su parte, la malattia leventinese o drusas dominantes fueron descritas como drusas con herencia autosómica dominante25, inicialmente observada en pacientes que vivían en Leventine (Suiza)26, la que es una causa inusual de degeneración macular causada por una mutación en el EGF que contiene el gen de la proteína 1 simil-fibrilina de la matriz extracelular (EFEMP1)25. El diagnóstico se basa en la observación de un fundus con pequeñas drusas radiales27.
Se demostró en varios trabajos que la composición de las drusas en la glomerulonefritis membrano-proliferativa tipo II9,28, tipo I20 y mesangiocapilar tipo II18-19, es similar en cuanto a su ubicación subepitelial y composición por tratarse de complemento e inmunoglobulinas, al igual que las asociadas con la degeneración macular relacionada con la edad29.
En el estudio de Mullins et al. se evidenció que los depósitos sub-EPR en las glomerulonefritis membrano-proliferativas tipo II son numerosos e indistinguibles de los depósitos hallados en la degeneración macular relacionada con la edad. Estos se producen por la interacción entre la vitronectina, C5 y complejos C5b-9, entre otros29.
Las drusas, en especial las blandas, muestran señal aumentada en la autofluorescencia por la presencia de lipofuscina. Esto se relacionó en el estudio de Einbock et al. con cambios focales que conllevan a la progresión hacia una atrofia geográfica30. Por esto se sugiere realizar un seguimiento a largo plazo en este tipo de pacientes con el fin de detectar estos hallazgos de forma precoz.
Finalmente, D’Souza et al. realizaron un seguimiento por más de 10 años a pacientes con glomerulonefritis mesangiocapilar donde evidenciaron que la agudeza visual, al igual que las drusas, no se modificaron con el paso del tiempo y el trasplante renal que se realizó en los pacientes tampoco representó un factor de riesgo para la progresión de las lesiones retinales31.
Conclusión
Los hallazgos retinales en el fondo de ojos en los distintos tipos de glomerulonefritis suelen persistir por un largo tiempo, incluso luego del trasplante renal.
Es de gran valor la utilización de imágenes multimodales como RFG y OCT para realizar el diagnóstico y el seguimiento posterior de los pacientes con afectación del segmento posterior.
Se sugiere el control a largo plazo, con estudios que permitan un seguimiento prospectivo, con el fin de prevenir el desarrollo de complicaciones retinales como la DMRE y neovascularización coroidea.
Se necesitarán más estudios para determinar la incidencia a largo plazo en nuestro medio y que intenten esclarecer la fisiopatogenia para encontrar tratamientos más específicos que prevengan la afectación ocular.
Referencias
1. Yang Y, Zhang Z, Zhuo L, Chen DP, Li WG. The spectrum of biopsy-proven glomerular disease in China: a systematic review. Chin Med J (Engl) 2018; 131(6): 731-735. doi:10.4103/0366-6999.226906.
2. Woo KT, Chan CM, Chin YM et al. Global evolutionary trend of the prevalence of primary glomerulonephritis over the past three decades .Nephron Clin Pract 2010; 116(4): c337-c346. doi:10.1159/000319594.
3. Zhou FD, Zhao MH, Zou WZ, Liu G, Wang H. The changing spectrum of primary glomerular diseases within 15 years: a survey of 3331 patients in a single Chinese centre. Nephrol Dial Transplant 2009; 24(3): 870-876. doi:10.1093/ndt/gfn554.
4. Couser WG, Johnson RJ. Mechanisms of progressive renal disease in glomerulonephritis. Am J Kidney Dis 1994; 23(2): 193-198. doi:10.1016/s0272-6386(12)80971-1.
5. Kashgarian M, Sterzel RB. The pathobiology of the mesangium. Kidney Int 1992; 41(3): 524-529. doi:10.1038/ki.1992.74.
6. Cebeci Z, Bayraktar S, Oray M, Kir N. Multimodal imaging of membranoproliferative glomerulonephritis type II. Saudi J Ophthalmol 2016; 30(4): 260-263. doi:10.1016/j.sjopt.2016.11.005.
7. Mansour AM, Lima LH, Arevalo JF et al. Retinal findings in membranoproliferative glomerulonephritis. Am J Ophthalmol Case Rep 2017; 7: 83-90. doi:10.1016/j.ajoc.2017.06.011.
8. Ulbig MR, Riordan-Eva P, Holz FG, Rees HC, Hamilton PA. Membranoproliferative glomerulonephritis type II associated with central serous retinopathy. Am J Ophthalmol 1993; 116(4): 410-413. doi:10.1016/s0002-9394(14)71397-2.
9. D’souza YB, Jones CJ, Short CD, Roberts IS, Bonshek RE. Oligosaccharide composition is similar in drusen and dense deposits in membranoproliferative glomerulonephritis type II. Kidney Int 2009; 75(8): 824-827. doi:10.1038/ki.2008.658.
10. Bai J, Geng W, Mei Y et al. Effect of Huaier on the proliferation of mesangial cells in anti-thy-1 nephritis. Cell Physiol Biochem 2017; 42(6): 2441-2452. doi:10.1159/000480198.
11. Striker LJ, Doi T, Elliot S, Striker GE. The contribution of glomerular mesangial cells to progressive glomerulosclerosis. Semin Nephrol 1989; 9(4): 318-328.
12. Lai KN, Wang AY. IgA nephropathy: common nephritis leading to end-stage renal failure. Int J Artif Organs 1994; 17(9): 457-460.
13. Zhang A, Han Y, Wang B, Li S, Gan W. Beyond gap junction channel function: the expression of Cx43 contributes to aldosterone-induced mesangial cell proliferation via the ERK1/2 and PKC pathways. Cell Physiol Biochem 2015; 36(3): 1210-1222. doi:10.1159/000430291.
14. Gómez-Guerrero C, Hernández-Vargas P, López-Franco O, Ortiz-Muñoz G, Egido J. Mesangial cells and glomerular inflammation: from the pathogenesis to novel therapeutic approaches. Curr Drug Targets Inflamm Allergy 2005; 4(3): 341-351. doi:10.2174/1568010054022169.
15. Tamouza H, Chemouny JM, Raskova Kafkova L et al. The IgA1 immune complex-mediated activation of the MAPK/ERK kinase pathway in mesangial cells is associated with glomerular damage in IgA nephropathy. Kidney Int 2012; 82(12): 1284-1296. doi:10.1038/ki.2012.192.
16. Chiang CK, Sheu ML, Hung KY, Wu KD, Liu SH. Honokiol, a small molecular weight natural product, alleviates experimental mesangial proliferative glomerulonephritis. Kidney Int 2006; 70(4): 682-689. doi:10.1038/sj.ki.5001617.
17. Gao J, Wu L, Wang Y et al. Knockdown of Cxcl10 inhibits mesangial cell proliferation in murine habu nephritis via ERK signaling. Cell Physiol Biochem 2017; 42(5): 2118-2129. doi:10.1159/000479914.
18. Duvall-Young J, Short CD, Raines MF, Gokal R, Lawler W. Fundus changes in mesangiocapillary glomerulonephritis type II: clinical and fluorescein angiographic findings. Br J Ophthalmol 1989; 73(11): 900-906. doi:10.1136/bjo.73.11.900.
19. Duvall-Young J, MacDonald MK, McKechnie NM. Fundus changes in (type II) mesangiocapillary glomerulonephritis simulating drusen: a histopathological report. Br J Ophthalmol 1989; 73(4): 297-302. doi:10.1136/bjo.73.4.297.
20. Han DP, Sievers S. Extensive drusen in type I membranoproliferative glomerulonephritis. Arch Ophthalmol 2009; 127(4): 577-579. doi:10.1001/archophthalmol.2009.38.
21. Pauleikhoff D, Barondes MJ, Minassian D, Chisholm IH, Bird AC. Drusen as risk factors in age-related macular disease. Am J Ophthalmol 1990; 109(1): 38-43. doi:10.1016/s0002-9394(14)75576-x.
22. Guigui B, Leveziel N, Martinet V et al. Angiography features of early onset drusen. Br J Ophthalmol 2011; 95(2): 238-244. doi:10.1136/bjo.2009.178400.
23. Gass JD. Stereoscopic atlas of macular diseases. St Louis: C. V. Mosby, 1977.
24. Leys A, Vanrenterghem Y, Van Damme B, Snyers B, Pirson Y, Leys M. Fundus changes in membranoproliferative glomerulonephritis type II: a fluorescein angiographic study of 23 patients. Graefes Arch Clin Exp Ophthalmol 1991; 229(5): 406-410. doi:10.1007/BF00166300.
25. Stone EM, Lotery AJ, Munier FL et al. A single EFEMP1 mutation associated with both Malattia Leventinese and Doyne honeycomb retinal dystrophy. Nat Genet 1999; 22(2): 199-202. doi:10.1038/9722.
26. Pager CK, Sarin LK, Federman JL et al. Malattia leventinese presenting with subretinal neovascular membrane and hemorrhage. Am J Ophthalmol 2001; 131(4): 517-518. doi:10.1016/s0002-9394(00)00821-7.
27. Piguet B, Haimovici R, Bird AC. Dominantly inherited drusen represent more than one disorder: a historical review. Eye (Lond) 1995; 9 (Pt 1): 34-41. doi:10.1038/eye.1995.5.
28. Mullins RF, Aptsiauri N, Hageman GS. Structure and composition of drusen associated with glomerulonephritis: implications for the role of complement activation in drusen biogenesis. Eye (Lond) 2001; 15(Pt 3): 390-395. doi:10.1038/eye.2001.142.
29. Mullins RF, Russell SR, Anderson DH, Hageman GS. Drusen associated with aging and age-related macular degeneration contain proteins common to extracellular deposits associated with atherosclerosis, elastosis, amyloidosis, and dense deposit disease. FASEB J 2000; 14(7): 835-846.
30. Einbock W, Moessner A, Schnurrbusch UE, Holz FG, Wolf S; FAM Study Group. Changes in fundus autofluorescence in patients with age-related maculopathy. Correlation to visual function: a prospective study. Graefes Arch Clin Exp Ophthalmol 2005; 243(4): 300-305. doi:10.1007/s00417-004-1027-3.
31. D’souza Y, Short CD, McLeod D, Bonshek RE. Long-term follow-up of drusen-like lesions in patients with type II mesangiocapillary glomerulonephritis. Br J Ophthalmol 2008; 92(7): 950-953. doi:10.1136/bjo.2007.130138.