CASOS CLÍNICOS
Amiloidosis vítrea y glaucoma secundario en paciente con polineuropatía amiloidótica familiar variante Ala36Pro: un reporte de caso y revisión
Camila Casas, Nicolás Frank, María Belén Buzzi, María Angélica Moussalli, Federico Fernández, Esteban Virguez
Hospital Bernardino Rivadavia, Buenos Aires, Argentina.
Recibido: 19 de diciembre de 2024.
Aprobado: 14 de mayo de 2025.
Autor corresponsal
Dra. Camila Casas
Servicio de Oftalmología
Hospital Bernardino Rivadavia
Av. Gral. Las Heras 2670
(C1425ASQ) Buenos Aires, Argentina.
+54 (011) 4809-2000
Oftalmol Clin Exp (ISSNe 1851-2658)
2025; 18(2): e222-e228.
https://doi.org/10.70313/2718.7446.v18.n2.429
Resumen
Objetivo: Describir un caso de amiloidosis ocular con afectación vítrea y glaucoma secundario con polineuropatía amiloidótica familiar (FAP), variante Ala36Pro.
Caso clínico: Se trata de una paciente de 30 años con diagnóstico genético de polineuropatía amiloidótica familiar. Estaba en seguimiento neurológico por neuropatía y afectación de diversos órganos además de la amiloidosis ocular. Este caso se asoció a depósitos en humor vítreo y en trabeculado, resultando en disminución de agudeza visual por cataratas y glaucoma secundario además de la turbidez vítrea. Se realizó facoemulsificación con implante de lente intraocular más una vitrectomía completa en ojo izquierdo (OI). La paciente mejoró la visión y no volvió a los controles pautados. Ocho meses más tarde regresó con disminución de AV del OI evidenciándose nuevo depósito de amiloide retrolental y una PIO en ojo derecho (OD) de 34 mmHg y en OI de 22 mmHg. Se detectó ángulo abierto, goniodisgenesia y material amiloide en ambos ojos. En ultrabiomicroscopía se observó material hiperreflectivo en cara anterior y posterior del iris y material en la malla trabecular compatible con depósito de amiloide. Se indicó tratamiento hipotensor con latanoprost y dorzolamida/timolol pudiendo actualmente regular su PIO y mantener una conducta expectante de seguimiento.
Conclusión: La amiloidosis vítrea se puede asociar frecuentemente con glaucoma secundario, como ocurrió en este caso. La afectación visual puede resolverse en parte mediante la vitrectomía, pero como enfermedad el material amiloide se sigue produciendo, el glaucoma podría recurrir y se deberá seguir de cerca el caso para manejar varias complicaciones asociadas.
Palabras clave: amiloidosis vítrea, glaucoma secundario, polineuropatía amiloidótica familiar.
Vitreous amyloidosis and secondary glaucoma in patient with familial amyloidotic polyneuropathy Ala36Pro variant: a case report and review
Abstract
Objective: To describe a case of ocular amyloidosis with vitreous involvement and secondary glaucoma, with Familial Amyloidotic Polyneuropathy (FAP), Ala36Pro variant.
Case report: This is a 30-year-old female patient with a genetic diagnosis of familial amyloidotic polyneuropathy. She was under neurological follow-up for neuropathy and involvement of various organs, in addition to ocular amyloidosis. Our case was associated with vitreous humor and trabecular deposits, resulting in decreased visual acuity (VA) due to cataracts and secondary glaucoma, in addition to vitreous turbidness. Phacoemulsification was performed with intraocular lens implantation plus a complete vitrectomy in the left eye (LE). The patient’s vision improved and she did not return to the prescribed controls. Eight months later she returned with decreased VA of the LE, showing new retrolental amyloid deposition and IOP in the right eye (RE) 34 mmHg and in the LE 22 mmHg. Open angle, goniodigeneses and amyloid material were detected in both eyes. Ultrabiomicroscopy (UBM) showed hyperreflective material in the anterior and posterior iris and material in the trabecular meshwork, compatible with amyloid deposit. Hypotensive treatment with latanoprost and dorzolamide/timolol is indicated, and the patient is currently able to regulate his IOP, maintaining a watchful waiting follow-up.
Conclusion: Vitreous amyloidosis can be frequently associated with secondary glaucoma, as in our case. The visual impairment could be partially resolved.
Keywords: vitreous amiloidosis, secondary glaucoma, familial amyloidotic polyneuropathy.
Amiloidose vítrea e glaucoma secundário em paciente com polineuropatia amiloidótica familiar variante Ala36Pro: relato de caso e revisão
Resumo
Objetivo: Descrever um caso de amiloidose ocular com envolvimento vítreo e glaucoma secundário à polineuropatia amiloidótica familiar (PAF), variante Ala36Pro.
Caso clínico: Trata-se de uma paciente de 30 anos com diagnóstico genético de polineuropatia amiloide familiar. Ela estava em acompanhamento neurológico por neuropatia e acometimento de vários órgãos, além de amiloidose ocular. Este caso estava associado a depósitos no humor vítreo e trabecular, resultando em diminuição da acuidade visual por catarata e glaucoma secundário, além de opacidade vítrea. Foi realizada facoemulsificação com implante de lente intraocular e vitrectomia completa em olho esquerdo (OE). A paciente apresentou melhora da visão e não retornou para as consultas de acompanhamento programadas.
Oito meses após, o paciente retornou com diminuição da AV do OE, revelando novo depósito de amiloide retrolental e PIO de 34 mmHg no olho direito (OD) e 22 mmHg no OE. Ângulo aberto, goniodisgenesia e material amiloide foram detectados em ambos os olhos. A biomicroscopia ultrassonográfica revelou material hiperrefletivo nas superfícies anterior e posterior da íris e material na malha trabecular, compatível com depósito de amiloide. Foi indicado tratamento hipotensivo com latanoprosta e dorzolamida/timolol, e a PIO do paciente pode ser regulada e ele está sendo monitorado expectantemente.
Conclusão: A amiloidose vítrea pode frequentemente estar associada ao glaucoma secundário, como aconteceu neste caso. A deficiência visual pode ser parcialmente resolvida com vitrectomia, mas, como a doença continua a produzir material amiloide, o glaucoma pode recorrer, e o caso requer monitoramento rigoroso para o manejo de diversas complicações associadas.
Palavras-chave: amiloidose vítrea, glaucoma secundário, polineuropatia amiloidótica familiar.
Introducción
La amiloidosis es un muy buen ejemplo de lo que se conoce como proteo-toxicidad, es decir, toxicidad mediada por proteínas. En este caso, la proteína implicada adquiere una conformación anormal, rígida, que se deposita en general en el espacio extracelular deteriorando la estructura parenquimatosa y determinando la insuficiencia de los órganos a los que afecta como pueden ser hígado1, riñón, corazón, articulaciones y también los ojos2.
La amiloidosis ocular se caracteriza por depósitos de amiloide en vítreo cuya clínica es un descenso marcado en la agudeza visual incapacitante. Por lo que se plantea la realización de vitrectomía, aunque en diversos artículos se sugiere la importancia de que sea incompleta para evitar un glaucoma secundario.
El glaucoma en la amiloidosis, a su vez, si bien puede ser secundario a la vitrectomía, también puede ser causado por depósitos de amiloide tanto en ambas caras del iris como en el trabeculado, resultando en un aumento de presión intraocular per se. Por lo que su tratamiento, cuando no responde a medicación tópica, debe ser alguna técnica filtrante y se debe considerar a la valvular como la más adecuada en este caso. Nuestro propósito es presentar un caso donde se combinan todas estas alteraciones.
Caso clínico
Se presenta a la consulta una paciente femenina de 30 años de edad con diagnóstico genético de polineuropatía amiloidótica familiar con mutación en la variante Ala36Pro, en seguimiento con los servicios de neurología por neuropatía autonómica asociada a constipación y síndrome de Raynaud, y neuropatía periférica con apalestesia de miembros superiores e inferiores asociado a trastornos sensitivos y motores de la marcha, en seguimiento además con el servicio de hepatología en plan de trasplante hepático, nefrología por calcificaciones renales, cardiología por miocardiopatía dilatada con disfunción diastólica leve, y con el servicio de psiquiatría por trastorno esquizoafectivo. La consulta oftalmológica fue por disminución de agudeza visual (AV) de ambos ojos de forma progresiva.
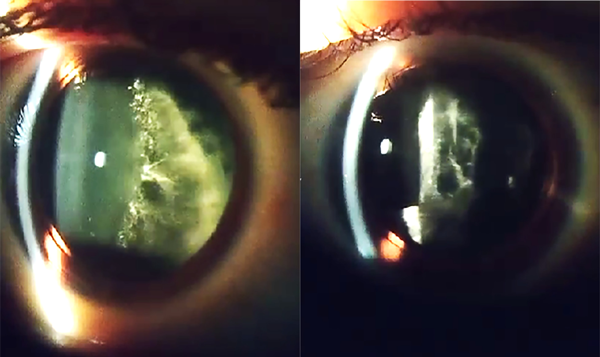
Como antecedente ocular la paciente concurrió con una vitrectomía completa realizada 2 años previos. El examen ocular presentaba una AV con estenopeico en OD de visión cuenta dedos a 50 cm y en OI, visión bultos. A la biomicroscopía como único dato positivo presentaba catarata córtico-nuclear en AO. El fondo de ojos no era evaluable por presencia de material amiloide a nivel retrolental de ambos ojos, la presión intraocular (PIO) era de 12 mmHg en AO. Se realizó ecografía que evidenció material hiperreflectivo de mediana y alta intensidad a nivel retrolental en AO con retina aplicada. Por lo que se decidió efectuar en conjunto con el servicio de retina facoemulsificación con implante de lente intraocular más una vitrectomía completa en OI (fig. 1). Luego de eso la paciente consiguió una AV de OI de 8/10 al mes de efectuada la faco y no regresó a los controles médicos pautados.

Figura 1. Depósitos de amiloide vítreos en OD vitrectomizado previamente y en OI con facovitrectomía realizada.
Sin embargo, ocho meses después, la paciente consultó nuevamente por disminución de AV de OI con una AV mejor corregida de 5/10, y se evidenciaba nuevo depósito de amiloide retrolental en OI, una PIO en OD 34 mmHg y en OI de 22 mmhg, se hizo una gonioscopía evidenciándose ángulo abierto, goniodisgenesia y material amiloide en AO y una sinequia aislada en hora 10 en OI (probablemente secundario a procedimiento quirúrgico). Se decidió realizar una ultrabiomicroscopía donde se pudo valorar la presencia de material hiperreflectivo en cara anterior y posterior del iris y material en la malla trabecular, compatible con depósito de amiloide (fig. 2).
Se indicó tratamiento médico hipotensor con latanoprost y dorzolamida/timolol y se pudo regular su presión intraocular. El paciente se mantiene en seguimiento.
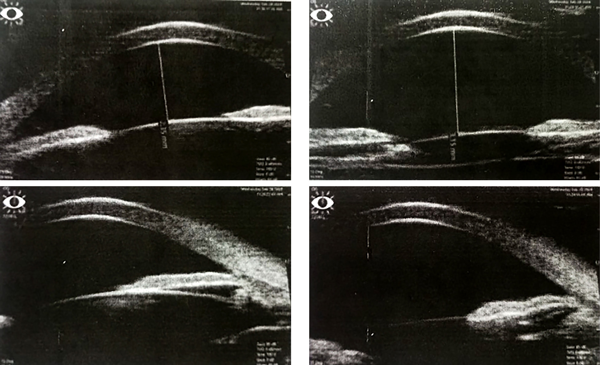
Figura 2. Hiperreflectividad en caras anterior y posterior del iris de ambos ojos compatible con amiloide. Puede evidenciarse en la imagen izquierda inferior depósito de placa amiloidótica en ángulo.
Discusión
El diagnóstico de los depósitos de amiloide se realiza a través de la anatomía patológica de cualquier órgano/tejido involucrado y al descubrir la presencia de sustancia amorfa teñida con rojo Congo3. Sin embargo, esto nos confirma la presencia de proteínas pero no su tipificación. Debemos tener presente que la proteínas amiloidogénicas se clasifican en adquiridas y congénitas. Dentro de las adquiridas tenemos los ejemplos de las cadenas livianas de las discrasias plasmocelulares; y dentro de las formas congénitas, la proteína más importante en este grupo es la transtirretina (TTR). Se trata de una proteína transportadora de hormonas, particularmente de la hormona tiroidea. La TTR mutada y aún la no mutada son capaces de depositarse en forma de amiloide. Se conoce desde hace años la forma de polineuropatía familiar hereditaria (FAP) relacionada con la población portuguesa (Portugal y Brasil) cuya mutación es la Val30Met4. El diagnóstico se basa en la identificación de mutaciones presentes en el ADN codificante de la proteína. Si bien puede ser realizado por PCR (reacción en cadena de la polimerasa), la forma ideal es la secuenciación de los 4 exones del gen. Con esta tecnología no solo se pone en evidencia la mutación Val30Met sino que se han identificado muchas otras. Los cuadros clínicos relacionados con estas nuevas mutaciones son variados y pueden comprometer el corazón, el sistema nervioso autónomo, el riñón, la neuropatía periférica y compromiso del sistema nervioso central y las meninges. Frente a esta variedad clínica se impone el estudio cuidadoso de las mutaciones del gen TTR para evitar perder diagnóstico. En el caso de nuestra paciente, se investigaron variantes de secuencia en exones 2, 3 y 4 del gen de TTR, encontrándose como resultado la variante heterocigota p.Ala36Pro cuya clínica se asocia a síndrome de túnel carpiano, amiloidosis ocular y polineuropatía4-5. Tal mutación se encuentra dentro de las llamadas No-Val30Met, muy poco frecuente de hallar6-7.
Como mencionamos previamente, la amiloidosis puede estar asociada a glaucoma de manera secundaria. En una revisión retrospectiva de dos informes de caso de Nelson et al. se encontró que la causa del aumento de presión intraocular puede darse por aumento de presión venosa epiescleral por amiloidosis orbitaria o por obstrucción del trabeculado por depósitos de amiloide en humor acuoso, vítreo y en la superficie tanto cristaliniana como iridiana8, como también reportan los autores Minnella et al. y Beirão et al., quienes indican que la ATTR se encuentra ampliamente distribuida en los tejidos oculares de los pacientes afectados9-10 y se han identificado depósitos de amiloide en el endotelio corneal, la cápsula del cristalino, el epitelio del iris, el epitelio pigmentario de la retina, el epitelio pigmentario ciliar, el cuerpo vítreo, la conjuntiva, la malla trabecular, las glándulas lagrimales y en las capas de fibras nerviosas de la retina8-11.
Una mención importante son las opacidades vítreas que resultan el cambio específico más común de la población ATTR Met30Val de aparición tardía12, como es el caso de nuestra paciente, con la particularidad de que la mutación que ella presenta no es la más común asociada a esas opacidades (Ala36Pro). Existen cuatro tipos de opacidades vítreas amiloides: pseudópodos lenticulares, fibrillas, opacidades esféricas y opacidades prevasculares12. Los pseudópodos lenticulares y las fibrillas típicas —por ser numerosas y densas— son patognomónicas, como en el caso de nuestra paciente. Se menciona también en el artículo de Ferreira et al. que el glaucoma relacionado con la polineuropatía amiloidótica familiar ATTR suele ser un glaucoma secundario agresivo de ángulo abierto12. Con frecuencia requiere de cirugía, ya sea trabeculectomía o implantes de válvulas, y conduce a la ceguera si no se trata. Además describe casos de microangiopatía retinal amiloide con isquemia periférica de retina como una manifestación poco frecuente que puede observarse en la etapa avanzada de la enfermedad12.
Como hemos mencionado, tanto la variante Met30Val como la Ala36Pro se asocian no sólo a opacidades vítreas sino también a glaucoma secundario13. Debemos tener en cuenta al momento de realizar una vitrectomía por pars plana (VPP), la posibilidad de que dicha intervención quirúrgica incremente los valores de presión intraocular, empeorando la evolución del glaucoma y acelerando la necesidad de cirugía filtrante y conduciendo en algunos casos a ceguera14. Se cree que la invasión quirúrgica causada por la VPP causa la difusión de fibrillas de amiloide —especialmente en la malla trabecular—, lo que podría ser la causa de la elevación de la PIO observada después de la VPP15-16.
Cuando se realiza una VPP incompleta, el cuerpo vítreo restante podría actuar potencialmente como un filtro para retener las fibrillas de amiloide, disminuyendo su depósito en la malla trabecular13. Por lo que se sugiere hacer no sólo una VPP incompleta, sino también un riguroso seguimiento de PIO con cirugía filtrante de ser necesario, para mantener una adecuada función visual.
Sin embargo, un estudio prospectivo realizado por You et al. explica que existe un alto riesgo de formación de roturas de retina iatrogénicas intraoperatoriamente debido a fuertes adherencias vitreorretinales, especialmente en la proximidad de los vasos retinales17; así como también Doft e Irvine et al. informaron sobre el desarrollo de desprendimientos de retina y de recurrencia postoperatoria de opacidades vítreas18-19. Por lo tanto, consideran que el cirujano no solo debe eliminar el vítreo lo más completamente posible, sino también evitar la aparición de roturas de retina iatrogénicas intraoperatoriamente mediante la revisión de toda la retina antes de finalizar el procedimiento y, en caso de rotura iatrogénica, tratar con fotocoagulación o criopexia para evitar desprendimientos de retina.
A su vez, las dificultades de la cirugía también radican en la eliminación completa del vítreo y la recurrencia postoperatoria de opacidades vítreas, que se cree que podrían causarse principalmente por dos mecanismos: la dispersión de opacidades vítreas residuales y la producción intraocular de fibrillas amiloides después de la cirugía17.
En un estudio realizado por Sandgren en 1995, se informó que de 32 ojos a los que se les había realizado vitrectomía completa, 2 necesitaron de cirugía filtrante y 6 recurrieron con amiloidosis vítrea requiriendo de nueva vitrectomía20. Sin embargo, Teruyoshi et al., en 2 reportes de caso de pacientes con previa trabeculectomía hecha, realizaron 25 G VPP, dejando intencionalmente vítreo periférico por la teoría del efecto antiglaucomatoso del depósito de amiloide en él, evitando que se dirija a la malla trabecular21; sin embargo, no describieron que hubiese una mejoría en la PIO a largo plazo.
Para finalizar, es importante destacar el artículo publicado por Takahiro et al. donde se describe una técnica innovadora en el tratamiento de las recurrencias producto de la formación constante de material amiloide22. Debido a que la melanina en el EPR es la principal sustancia en la retina que absorbe la luz láser, ellos plantean la hipótesis de que la fotocoagulación láser conduciría a la destrucción del EPR y, debido a que el EPR sintetiza ATTR, se podría prevenir la formación de amiloide ocular. Los parámetros del tratamiento fueron: tiempos de exposición de 200 mseg, diámetros de spot de 200 µm, lesiones de láser aplicadas en 4 o 5 sesiones cada 2 semanas de a 400-500 spots en 1 sesión, realizado en 2 pacientes, en lo que luego del seguimiento se observó en ambos casos que los ojos no tratados requirieron de cirugía filtrante y los ojos tratados disminuyeron drásticamente la producción de amiloide con el mantenimiento de agudeza visual.
Conclusión
El caso presentado nos permite subrayar la importancia de los controles oculares en los pacientes con amiloidosis, destacando la frecuente asociación entre la amiloidosis vítrea y el glaucoma. Debemos recordar que existe una continua producción de amiloide, lo que puede generar recurrencias, haciendo relevante los seguimientos cercanos para poder detectar potenciales cambios y tratarlos oportunamente.
Referencias
1. Barreiros AP, Post F, Hoppe-Lotichius M et al. Liver transplantation and combined liver-heart transplantation in patients with familial amyloid polyneuropathy: a single-center experience. Liver Transpl 2010; 16(3): 314-323. doi:10.1002/lt.21996.
2. Brailovsky Y, Rajapreyar I, Alvarez R. TTR amyloidosis: current state of affairs and promise for the future. JACC Case Rep 2023; 10: 101759. doi:10.1016/j.jaccas.2023.101759.
3. Pilotte J, Huang AS, Khoury S et al. Detection of TTR amyloid in the conjunctiva using a novel fluorescent ocular tracer. Transl Vis Sci Technol 2024; 13(2): 11. doi:10.1167/tvst.13.2.11.
4. Lachmann HJ, Goodman HJ, Gilbertson JA et al. Natural history and outcome in systemic AA amyloidosis. N Engl J Med 2007; 356(23): 2361-2371. doi:10.1056/NEJMoa070265.
5. Murrell JR, Schoner RG, Liepnieks JJ, Rosen HN, Moses AC, Benson MD. Production and functional analysis of normal and variant recombinant human transthyretin proteins. J Biol Chem 1992; 267(23): 16595-16600.
6. Jones LA, Skare JC, Harding JA, Cohen AS, Milunsky A, Skinner M. Proline at position 36: a new transthyretin mutation associated with familial amyloidotic polyneuropathy. Am J Hum Genet 1991; 48(5): 979-982.
7. Jacobson DR, Rosenthal CJ, Buxbaum JN. Transthyretin Pro 36 associated with familial amyloidotic polyneuropathy in an Ashkenazic Jewish kindred. Hum Genet 1992; 90(1-2): 158-160. doi:10.1007/BF00210764.
8. Nelson GA, Edward DP, Wilensky JT. Ocular amyloidosis and secondary glaucoma. Ophthalmology 1999; 106(7): 1363-1366. doi:10.1016/S0161-6420(99)00726-5.
9. Minnella AM, Rissotto R, Antoniazzi E et al. Ocular involvement in hereditary amyloidosis. Genes (Basel) 2021; 12(7): 955. doi:10.3390/genes12070955.
10. Beirão JM, Malheiro J, Lemos C, Beirão I, Costa P, Torres P. Ophthalmological manifestations in hereditary transthyretin (ATTR V30M) carriers: a review of 513 cases. Amyloid 2015; 22(2): 117-122. doi:10.3109/13506129.2015.1015678.
11. Ando E, Ando Y, Okamura R, Uchino M, Ando M, Negi A. Ocular manifestations of familial amyloidotic polyneuropathy type I: long-term follow up. Br J Ophthalmol 1997; 81(4): 295-298. doi:10.1136/bjo.81.4.295.
12. Ferreira, N. Ophtalmologic changes in transthyretin familial amyloid polyneuropathy (ATTR-FAP). Orphanet J Rare Dis 2015; 10 (Suppl 1): I9. doi:10.1186/1750-1172-10-S1-I9.
13. Pathak-Ray V, Pulpa V, Blyth C. Vitreous amyloidosis and secondary glaucoma-a case report. Eye (Lond) 2002; 16(4): 492-494. doi:10.1038/sj.eye.6700075.
14. Dunlop AA, Graham SL. Familial amyloidotic polyneuropathy presenting with rubeotic glaucoma. Clin Exp Ophthalmol 2002; 30(4): 300-302. doi:10.1046/j.1442-9071.2002.00539.x.
15. Kakihara S, Hirano T, Imai A, Miyahara T, Murata T. Small gauge vitrectomy for vitreous amyloidosis and subsequent management of secondary glaucoma in patients with hereditary transthyretin amyloidosis. Sci Rep 2020; 10(1): 5574. doi:10.1038/s41598-020-62559-x.
16. Beirão NM, Matos ME, Meneres MJ, Beirão IM, Costa PP, Torres PA. Vitreous surgery impact in glaucoma development in liver transplanted familial amyloidosis ATTR V30M Portuguese patients. Amyloid 2012; 19(3): 146-151. doi:10.3109/13506129.2012.710669.
17. You J. Vitrectomy for vitreous amyloidosis. Int J Ophthalmol 2011; 4(3): 307-310. doi:10.3980/j.issn.2222-3959.2011.03.20.
18. Doft BH, Machemer R, Skinner M et al. Pars plana vitrectomy for vitreous amyloidosis. Ophthalmology 1987; 94(6): 607-611. doi:10.1016/s0161-6420(87)33402-5.
19. Irvine AR, Char DH. Recurrent amyloid involvement in the virreous body after vitrectomy. Am J Ophthalmol 1976; 82(5): 705-708. doi:10.1016/0002-9394(76)90006-4.
20. Sandgren O. Ocular amyloidosis, with special reference to the hereditary forms with vitreous involvement. Surv Ophthalmol 1995; 40(3): 173-196. doi:10.1016/s0039-6257(95)80025-5.
21. Miyahara T, Ohta K, Yamamoto Y, Ueno A, Murata T. 25-gauge vitrectomy to treat ocular complications of familial amyloid polyneuropathy. J Glaucoma 2007; 16(1): 169-170. doi:10.1097/01.ijg.0000212291.85669.21.
22. Kawaji T, Ando Y, Hara R, Tanihara H. Novel therapy for transthyretin-related ocular amyloidosis: a pilot study of retinal laser photocoagulation. Ophthalmology 2010; 117(3): 552-555. doi:10.1016/j.ophtha.2009.07.042.