ARTÍCULOS ORIGINALES
Regeneración corneal mediante tratamiento con vesículas extracelulares derivadas de células madre mesenquimales en un modelo murino de injuria alcalina
Diego Mario Santa Cruza, María José Canterob, Esteban Fioreb, Natalia Alejandra Pacienzaa
aLaboratorio de Regulación Génica y Células Madre, Instituto de Medicina Traslacional, Trasplante y Bioingeniería, Consejo Nacional de Investigaciones Científicas y Técnicas-Universidad Favaloro, Buenos Aires, Argentina.
bLaboratorio de Hematología Experimental y Terapia Génica, Instituto de Medicina Traslacional, Trasplante (IIMT)-Consejo Nacional de Investigaciones Científicas y Técnicas-Universidad Austral, Pilar (Buenos Aires), Argentina.
Recibido: 12 de marzo de 2025.
Aprobado: 30 de mayo 23 2025.
Autor corresponsal
Prof. Dra. Natalia Alejandra Pacienza
Laboratorio de Regulación Génica y Células Madre, Instituto de Medicina Traslacional, Trasplante y Bioingeniería
Universidad Favaloro
Instituto de Medicina Traslacional, Transplante y Bioingeniería (IMETTyB)
Solís 453
(1078) Buenos Aires, Argentina
npacienza@favaloro.edu.ar
Oftalmol Clin Exp (ISSNe 1851-2658)
2025; 18(2): e143-e152.
https://doi.org/10.70313/2718.7446.v18.n2.421
Resumen
Objetivo: En los últimos años estudiamos las propiedades regenerativas, anti-inflamatorias e inmuno-moduladoras de las vesículas extracelulares (EVs) secretadas por células madre mesenquimales (MSCs). Debido a que los procesos que conllevan a la opacidad corneal se deben básicamente a una desregulación de mecanismos regenerativos e inflamatorios, en el presente trabajo nos propusimos evaluar el potencial terapéutico de las EVs derivadas de MSCs en un modelo experimental de injuria corneal.
Métodos: Previamente desarrollamos un sistema de aislamiento de vesículas extracelulares y posterior análisis de su potencial antiinflamatorio (in vitro). Este sistema de producción y aislamiento de EVs está comprendido por cultivo controlado de MSCs (de cordón umbilical humano), recolección de medio condicionado y purificación de EVs mediante cromatografía de intercambio iónico. En este estudio pusimos a punto un modelo murino de regeneración corneal mediante aplicación tópica de 10 µl de NaOH (0,125 M) y posterior tratamiento con igual volumen de EVs (1x109 partículas/ml) por 5 días consecutivos. La acción terapéutica de las EVs se evaluó mediante tinción tisular (hematoxilina-eosina) y determinación de los niveles de expresión de citoquinas inflamatorias por real-time RT-PCR.
Resultados: Tanto en la observación clínica, como en la tisular, se observa que el NaOH indujo injuria moderada del tejido corneal con un claro restablecimiento del tejido luego del tratamiento con vesículas (vs vehículo). Respecto a las citoquinas evaluadas, estas aumentaron significativamente su expresión luego de la injuria química y descendieron fuertemente tras el tratamiento con EVs (n=5, p<0,05).
Conclusión: De los resultados obtenidos se desprende que logramos establecer un modelo sencillo de injuria del epitelio corneal en el que testear diversas estrategias terapéuticas y, a su vez, demostramos el enorme potencial regenerativo de las EVs en patologías oculares de orden inflamatorio.
Palabras clave: células madre mesenquimales estromales, vesículas extracelulares, regeneración corneal.
Mesenchymal stromal cells-derived extracellular vesicles for corneal regeneration in an experimental model of corneal injury
Abstract
Objective: In recent years, our research has focused on the regenerative, anti-inflammatory, and immunomodulatory properties of extracellular vesicles (EVs) secreted by mesenchymal stem cells (MSCs). Given that corneal opacity is primarily driven by dysregulation of regenerative and inflammatory pathways, the aim of this study was to evaluate the therapeutic potential of MSC-derived EVs in an experimental model of corneal injury.
Methods: We previously established a protocol for the isolation of EVs and the assessment of their anti-inflammatory effects in vitro. This protocol includes the controlled culture of MSCs derived from human umbilical cord tissue, collection of conditioned medium, and EV purification through ion-exchange chromatography. In this study, a murine model of corneal injury was developed by topical application of 10 µL of NaOH (0.125 M), followed by daily topical treatment with 10 µL of EVs (1×10⁹ particles/mL) for five consecutive days. Therapeutic efficacy was evaluated by histological staining (hematoxylin- eosin) and quantitative real-time RT-PCR analysis of inflammatory cytokines.
Results: Clinical and histological analyses revealed that NaOH application induced moderate corneal injury, which was significantly ameliorated following EV treatment compared to vehicle controls. Expression levels of inflammatory cytokines were markedly upregulated after chemical injury and significantly downregulated after EV administration (n=5, p<0.05).
Conclusion: Our findings demonstrate the successful establishment of a simple and reproducible model of corneal epithelial injury, suitable for evaluating new therapeutic approaches. Furthermore, the results underscore the potent regenerative and anti-inflammatory properties of MSC-derived EVs, highlighting their promising potential for the treatment of inflammatory ocular diseases.
Keywords: stromal mesenchymal stem cells, extracellular vesicles, corneal regeneration.
Regeneração da córnea por tratamento com vesículas extracelulares derivadas de células-tronco mesenquimais em modelo murino de lesão alcalina
Resumo
Objetivo: Nos últimos anos, estudamos as propriedades regenerativas, anti-inflamatórias e imunomoduladoras das vesículas extracelulares (VEs) secretadas por células-tronco mesenquimais (MSCs). Como os processos que levam à opacidade da córnea são principalmente devidos a uma desregulação dos mecanismos regenerativos e inflamatórios, neste estudo, objetivamos avaliar o potencial terapêutico das VEs derivadas de MSCs em um modelo experimental de lesão da córnea.
Métodos: Desenvolvemos previamente um sistema para o isolamento de vesículas extracelulares e posterior análise de seu potencial anti-inflamatório (in vitro). Este sistema de produção e isolamento de VEs consiste em cultura controlada de MSCs (de sangue de cordão umbilical humano), coleta de meio condicionado e purificação das VEs por cromatografia de troca iônica. Neste estudo, desenvolvemos um modelo murino de regeneração corneana por aplicação tópica de 10 µl de NaOH (0,125 M) e subsequente tratamento com o mesmo volume de VEs (1x109 partículas/ml) por 5 dias consecutivos. A ação terapêutica das VEs foi avaliada por coloração tecidual (hematoxilina-eosina) e determinação dos níveis de expressão de citocinas inflamatórias por RT-PCR em tempo real.
Resultados: As observações clínicas e teciduais demonstraram que o NaOH induziu lesão moderada do tecido corneano, com restauração tecidual evidente após o tratamento com vesículas (vs. veículo). Em relação às citocinas avaliadas, sua expressão aumentou significativamente após a lesão química e diminuiu acentuadamente após o tratamento com EVs (n = 5, p < 0,05).
Conclusão: Os resultados obtidos indicam que fomos capazes de estabelecer um modelo simples de lesão epitelial da córnea para testar diversas estratégias terapêuticas. Também demonstramos o enorme potencial regenerativo das EVs em patologias oculares inflamatórias.
Palavras-chave: células-tronco estromais mesenquimais, vesículas extracelulares, regeneração da córnea.
Introducción
Se ha demostrado que la córnea debe ser transparente a fin de cumplir de manera óptima con sus propiedades refractivas. La cicatrización corneal posterior a diversas causas de etiología infecciosa, inflamatoria, traumática o degenerativa, interfiere con el pasaje normal de la luz y conlleva a la pérdida de la visión. A nivel mundial se estima que aproximadamente 700.000 pacientes al año han sufrido claro deterioro de su visión debido a este tipo de alteraciones1. El estroma corneal está formado principalmente por los queratocitos, células responsables del mantenimiento de la matriz corneal mediante síntesis y remodelación de fibras de colágeno (predominantemente del tipo I). Esta macromolécula constituye aproximadamente el 71% del peso seco de la córnea y es responsable tanto de la transparencia tisular como de la resistencia mecánica. Los queratocitos se activan en caso de trauma o inflamación e interactúan a través de mediadores químicos (factores de crecimiento, citoquinas, metaloproteasas, entre otros) con las células del epitelio, modulando el proceso de cicatrización. Además, las células madre presentes en la unión esclero-corneal contribuyen al proceso de reepitelización. La transformación de queratocitos a miofibroblastos es un proceso normal de cicatrización en acción a una lesión, pero una respuesta exagerada puede llevar a fibrosis y opacidad por deposición de matriz extracelular desorganizada y consecuente formación de cicatrices. Los miofibroblastos liberan citoquinas proinflamatorias, como la interleucina IL-6, IL-8 y TNF-α, que actúan como quimioatrayentes para neutrófilos y linfocitos2. Por otro lado, en la capa estromal los macrófagos residentes pueden generar una respuesta rápida en donde, dependiendo de las señales bioquímicas, logran polarizarse hacia el fenotipo M1 (proinflamatorios) o bien M2 (reparadores)3-4. La regeneración de la córnea estará mediada, entonces, por la diferenciación celular, la activación de las células madre residentes en el sitio de la lesión y la secreción de citoquinas regenerativas o factores de crecimiento que pueden reducir la inflamación, remodelar los depósitos de colágeno y estimular la regeneración mediante la activación de diversas vías de señalización. En síntesis, la cicatrización y reparación tisular efectiva será el producto de la correcta concertación de los diferentes eventos moleculares y fenotípicos que cambian constantemente con el tiempo tras la lesión. En tejidos adultos, estos eventos suelen culminar en la formación de una cicatriz. Por lo tanto, un abordaje farmacológico temprano resulta de fundamental importancia para la reparación de la lesión con cicatrización sin cicatrices, así como en la regeneración de los tejidos nativos5.
Las células madre mesenquimales estromales (MSCs) son células multipotentes, no-hematopoyéticas, capaces de diferenciarse a distintos linajes y poseen actividad antiinflamatoria y antiapoptótica mediada por efectos parácrinos6. En la actualidad, se reconoce al efecto paracrino de las MSCs como el principal aportante en la regeneración tisular y es objeto actual de investigación el rol de las vesículas extracelulares (EVs) en este proceso. Son de particular interés las vesículas extracelulares pequeñas (sEVs), anteriormente denominadas exosomas, las que poseen un diámetro entre 50 a 130 nm y son liberadas por una amplia variedad de tipos celulares, incluyendo a las MSCs7. Las sEVs se forman por la gemación de vesículas intraluminales de los cuerpos multivesiculares endosomales y se liberan de las células tras su fusión con la membrana plasmática8. Las sEVs participan fisiológicamente en la comunicación intercelular, la reparación tisular y la respuesta inmunitaria, entre otras funciones. Se ha demostrado, que el contenido cuali y cuantitativo de proteínas de las sEVs refleja el de la célula parental transportando citoquinas, quimioquinas, moléculas de adhesión, proteínas de choque térmico, enzimas citoplasmáticas y proteínas involucradas en transducción de señales9. En los últimos años, las sEVs han cobrado gran relevancia clínica por considerarse biomarcadores de distintas patologías y constituir una novedosa herramienta terapéutica. En comparación con las terapias tradicionales de administración de MSCs, los tratamientos con sEVs tienen varias ventajas. Por ejemplo, exhiben menor inmunogenicidad y disminuyen el riesgo de diferenciación de las células donantes a otros linajes celulares10. Además, son fácilmente utilizables por sus cualidades de almacenamiento, administración e incorporación en la célula blanco y su aplicación sería similar a un producto farmacéutico off-the-shelf11-12.Esto ha impulsado a la comunidad científica a investigar su posible uso también como vehículos de distribución de una amplia variedad de agentes terapéuticos13-15.
En un modelo murino de desbridamiento epitelial se demostró que las EVs derivadas de MSCs corneales humanas son internalizadas por las células epiteliales, lo que a su vez aumenta su migración y proliferación in vitro y acelera la cicatrización de heridas in vivo16. Resultados similares se observaron en ensayos de herida por raspado en monocapa17. Las EVs presentan un papel inmunomodulador con polarización del pool de macrófagos hacia el fenotipo antiinflamatorio, reducción de moléculas proinflamatorias (IL-1β, IL-8 y TNF-α) y aumento de IL-10 (antiinflamatoria)18.
En los últimos años se estudian las propiedades regenerativas, antiinflamatorias e inmunomoduladoras de las sEVs secretadas por MSCs19-21. Las sEVs representan un enfoque terapéutico novedoso en el tratamiento de los trastornos de cicatrización de heridas corneales a través de la modulación de la comunicación intercelular y modificación del entorno inflamatorio y oxidativo del tejido dañado22. Debido a que los procesos que conllevan a la opacidad corneal se deben básicamente a una desregulación de mecanismos regenerativos e inflamatorios, en este trabajo nos propusimos poner a punto un modelo murino experimental de lesión corneal a fin de evaluar diferentes estrategias terapéuticas mediante aplicación tópica de sEVs derivadas de MSCs.
Materiales y métodos
Cultivo celular
Las MSCs derivadas de cordón umbilical humano se aislaron de acuerdo con procedimientos descritos previamente23. Se cultivaron en medio DMEM conteniendo 10% de suero fetal bovino (FBS) y crecieron hasta un 70%-90% de confluencia antes de realizar los pasajes. Se utilizaron células en pasaje 4 a 6 para todos los experimentos ya que se ha demostrado que conservan mejor su funcionalidad y producen grandes cantidades de EVs. Determinamos la presencia de marcadores de superficie positivos y negativos mediante citometría de flujo así como la capacidad de diferenciación a adipocitos, osteocitos y condrocitos para confirmar que las células cumplan con los criterios de definición de MSCs24.
Cultivo en medio libre de proteínas, purificación y caracterización sEVs
Una vez que el cultivo de MSCs se encontró al 70% de confluencia, se procedió a cambiar el medio de cultivo a una formulación químicamente definida y libre de proteínas: medio mínimo esencial alfa (α-MEM) sin FBS. Finalmente, se colectó el medio condicionado a las 48 horas de cultivo. El medio condicionado colectado se trató según Malvicini et al.20-21. Las distintas preparaciones de EVs se conservaron a -80°C hasta su uso. La caracterización se llevó a cabo mediante la identificación de su tamaño por tecnología de seguimiento individual de nanopartículas en tiempo-real (NanoSight, Malvern Panalytical) y presencia de marcadores específicos (CD9, CD63, CD81, CD82) por ELISA, Western blot y/o citometría de flujo.
Ensayo de polarización de macrófagos
Para la valoración in vitro de las características antiinflamatorias e inmunomoduladoras se analizó el efecto de las sEVs sobre el fenotipo de los macrófagos realizándose según el protocolo desarrollado por nuestro laboratorio (Universidad de Texas, Estados Unidos)19-20.
Modelo animal de opacidad corneal
Se empleó un modelo murino de injuria alcalina mejorado por Shadmani et al., en donde se reemplazó el papel de filtro por un trépano de biopsia modificado y se aplicó solución estéril de NaOH con ventajas significativas en reproducibilidad y estandarización de la injuria inicial25. Se utilizaron ratones machos 129S2 libres de patógenos y mantenidos en condiciones de asepsia en racks ventilados. Todos los procedimientos se realizaron de acuerdo con la Guía para el uso y cuidado de animales de laboratorio (NIH publication No. 85-23, revised 1996).
Determinación de expresión génica por real-time RT-PCR
Se colectaron 5 córneas por grupo. El tejido se congeló inmediatamente en nitrógeno líquido y se aisló el ARN total utilizando el reactivo TRIzol (Gibco-Life Technologies, Grand Island, NY). Antes de su uso posterior, el ARN total fue tratado con ADNasa I (1 U de ADNasa/1 µg de ARN total). Se diseñaron cebadores específicos de especie y se empleó la técnica de reacción en cadena de la polimerasa con transcripción inversa (RT-PCR) en tiempo real para comparar los niveles de expresión de ARNm de citoquinas inflamatorias murinas, incluido el TNF-α, IL-6 e interleuquina IL-1β.
Análisis estadístico
Los datos se expresaron como media ± DS. Se utilizó ANOVA con pos-test de Tukey para determinar diferencias significativas entre grupos. Se consideraron como estadísticamente significativos aquellos valores de p<0,05.
Resultados
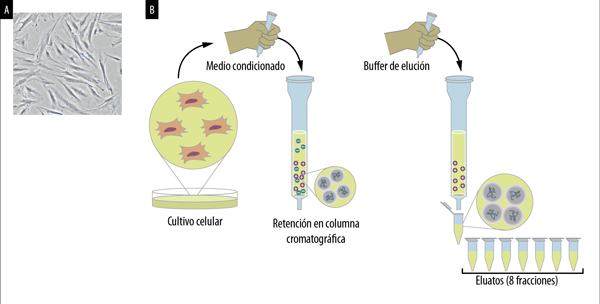
En los últimos años nuestro grupo realizó avances significativos en el estudio y caracterización de las sEVs derivadas de MSCs. Desarrollamos un sistema de cultivo en un medio químicamente definido y libre de proteínas (α-MEM sin SFB) (fig. 1A) que nos permitió colectar las EVs secretadas por las MSCs en un período de 48 horas y luego purificarlas del medio condicionado mediante un proceso de cromatografía de intercambio aniónico (fig. 1B). El análisis de distribución de tamaño de las EVs se realizó por tecnología de seguimiento individual de nanopartículas en tiempo-real. La fracción eluida de la columna presentó un tamaño homogéneo de partículas de entre 80-150 nm lo que indica la presencia de sEVs en ausencia de microvesículas. Las sEVs que purificamos también presentaron un elevado porcentaje de expresión de los marcadores CD63 y CD81 (considerados marcadores específicos). Estos resultados demuestran la alta pureza de las sEVs aisladas mediante nuestra tecnología. El poder inflamatorio de estas nanopartículas se evaluó en un ensayo in vitro mediante análisis de la inhibición de la activación de macrófagos murinos estimulados por LPS en presencia de las vesículas producidas.

Figura 1. (A) Microfotografía de cultivo celular de MSCs. (B) Esquema representativo del proceso de aislamiento y purificación de EVs del medio condicionado. Tras la elución del Sistema cromatográfico se obtienen 8 fracciones de 1 ml cada una encontrándose enriquecida en sEVs en la fracción 4 y 5 (adaptado de Domínguez26).
En este trabajo presentamos un estudio piloto en donde pusimos a punto el procedimiento de lesión o injuria corneal descrito por Shadmani et al.25. Realizamos nuestros ensayos preliminares empleando la técnica de quemadura corneal alcalina, mediante aplicación tópica de solución estéril de NaOH. Para realizar el procedimiento modificamos un trépano de biopsia (3,5 mm diámetro interno) que se empleó para administrar 10 µl de una solución estéril de NaOH 0,125 M sobre la superficie corneal manteniendo el contacto con el tejido durante 30 segundos (fig. 2). Se realizó el mismo procedimiento utilizando solución fisiológica estéril en el ojo contralateral. Una vez realizada la injuria se lavó profusamente la zona con 5 ml de solución fisiológica y se corroboró pH neutro mediante papel indicador de pH. El tratamiento se inició 4 horas poscirugía mediante administración tópica de 1 x 109 sEVs en solución estéril de solución fisiológica. Se aplicó un volumen de 10 µl sobre la superficie corneal lesionada una vez al día durante 5 días. Se administró el mismo volumen de solución fisiológica a las córneas no lesionadas del mismo animal (ojo contralateral).
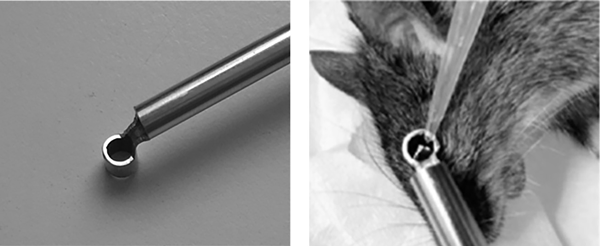
Figura 2. Trépano de biopsia modificado. Presenta un corte y un doblez a 90 grados en el extremo distal, y aplicación de solución con micropipeta automática en el modelo animal.
Transcurrido el tiempo de análisis, los animales se sometieron a eutanasia mediante administración de dióxido de carbono gaseoso. Ambos ojos fueron enucleados en los días 0 (4 horas posteriores a la lesión) y 5, y se tomaron muestras para análisis histológico (tinción hematoxilina/eosina). Se conservaron todos los contenidos internos de la esclera y una porción del nervio óptico. Se fijó en formaldehído taponado neutro al 10% durante 48 horas, se incluyó en parafina y se cortó en secciones de 5 μm de espesor. Las secciones se tiñeron con hematoxilina-eosina y se examinaron con un aumento de ×200. Se observó que la aplicación tópica de NaOH 0,125 M produce una injuria moderada que genera una lesión con pérdida total del epitelio como así también de la membrana de Bowman. Nótese en este último caso un engrosamiento de la capa estromal debido a la abundante formación de edema. Sin embargo, luego de cinco días de tratamiento con sEVs se observó una disminución significativa de la lesión y también signos de reepitelización (fig. 3).
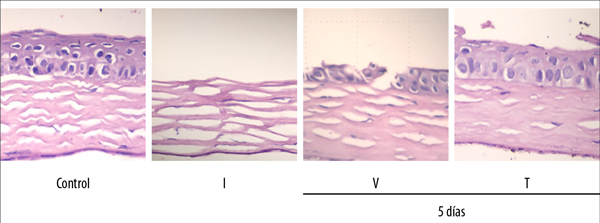
Figura 3. Secciones corneales de 5 micras de espesor, teñidas con hematoxilina-eosina. Se examinaron con un aumento de ×200. I: Injuria con NaOH 0.125 M; V: Vehículo (solución fisiológica); T: Tratado (1x10 9 sEVs en vehículo).
El análisis de nivel de expresión de transcritos para las citoquinas inflamatorias TNF-α, IL-6 e IL-1β mostró un aumento de ellas tras la lesión, efecto que se revierte significativamente luego de cinco días de tratamiento con sEVs (fig. 4). La reducción de su sobreexpresión indicaría que las sEVs estarían modulando el proceso inflamatorio a nivel tisular.
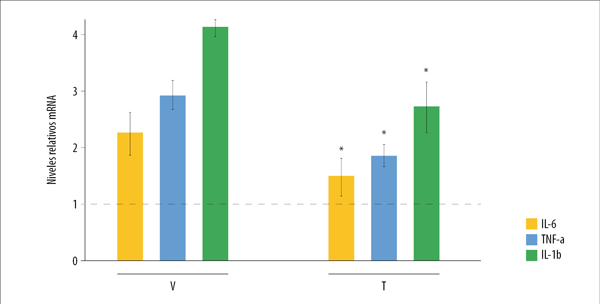
Figura 4. Análisis del nivel de expresión de transcritos para las citoquinas inflamatorias TNF-α, IL-6 e IL-1β medidas por técnica de RT-PCR en tiempo real. V: Vehículo (solución fisiológica). T: Tratado (1x10 9 sEVs en vehículo); (n=5, p<0.05).
Discusión
El desarrollo de nuevas estrategias para preservar, reparar y mejorar la calidad de la córnea tendría un gran impacto no solo en la disminución del número de trasplantes realizados, sino también en la mejora de la calidad de vida de los pacientes afectados. En este sentido, la terapia acelular, es decir mediante aplicación tópica de sEVs, representa una estrategia novedosa y promisoria, ya que su administración resultaría altamente beneficiosa debido a sus características inmunomoduladoras y antiinflamatorias. En el presente trabajo pudimos establecer un modelo sencillo murino de lesión del epitelio corneal en el que se testea en forma preliminar un tratamiento basado en administración de sEVs derivadas de MSCs de cordón umbilical humano. Tal modelo induce una quemadura química, precisa y reproducible en toda la córnea, adecuada para estudiar la inflamación del tejido y sus eventos fibróticos. Este método también es apropiado para investigar la eficacia preclínica y clínica de agentes terapéuticos oftalmológicos de aplicación tópica.
En lo que respecta a la producción de las sEVs empleadas en este estudio podemos discutir que son de alta calidad y conservan la actividad biológica luego del procedimiento de aislamiento, en comparación con otros métodos de uso corriente (ultracentrifugación diferencial). Por otro lado, la metodología de aislamiento por cromatografía de intercambio iónico presenta características de escalado que los otros métodos tradicionales carecen. Esto es de vital importancia a la hora de tener en cuenta esta tecnología para la producción a gran escala como la requerida para abordar un estudio preclínico o clínico.
Conclusión
Pudimos establecer un modelo sencillo de injuria del epitelio corneal donde testear diversas estrategias terapéuticas y demostrar el potencial uso de las sEVs en patologías de orden inflamatorio y regenerativo. En este trabajo presentamos resultados preliminares que nos permitirán avanzar hacia un estudio detallado de los mecanismos moleculares implicados en los beneficios terapéuticos observados, lo que contribuirá a establecer una futura terapia acelular para regeneración corneal mediante administración tópica de sEVs antiinflamatorias.
Referencias
1. Saccu G, Menchise V, Giordano C et al. Regenerative approaches and future trends for the treatment of corneal burn injuries. J Clin Med 2021; 10(2): 317. doi:10.3390/jcm10020317.
2. Liu Y, Kimura K, Yanai R, Chikama T, Nishida T. Cytokine, chemokine, and adhesion molecule expression mediated by MAPKs in human corneal fibroblasts exposed to poly(I:C). Invest Ophthalmol Vis Sci 2008; 49(8): 3336-3344. doi:10.1167/iovs.07-0972.
3. Liu J, Xue Y, Dong D et al. CCR2- and CCR2+ corneal macrophages exhibit distinct characteristics and balance inflammatory responses after epithelial abrasion. Mucosal Immunol 2017; 10(5): 1145-1159. doi:10.1038/mi.2016.139.
4. Liu J, Li Z. Resident innate immune cells in the cornea. Front Immunol 2021; 12: 620284. doi:10.3389/fimmu.2021.620284.
5. Jhanji V, Billig I, Yam GH. Cell-free biological approach for corneal stromal wound healing. Front Pharmacol 2021; 12: 671405. doi:10.3389/fphar.2021.671405.
6. Wu X, Jiang J, Gu Z, Zhang J, Chen Y, Liu X. Mesenchymal stromal cell therapies: immunomodulatory properties and clinical progress. Stem Cell Res Ther 2020; 11(1): 345. doi:10.1186/s13287-020-01855-9.
7. Kou M, Huang L, Yang J et al. Mesenchymal stem cell-derived extracellular vesicles for immunomodulation and regeneration: a next generation therapeutic tool? Cell Death Dis 2022; 13(7): 580. doi:10.1038/s41419-022-05034-x.
8. Klumperman J, Raposo G. The complex ultrastructure of the endolysosomal system. Cold Spring Harb Perspect Biol 2014; 6(10): a016857. doi:10.1101/cshperspect.a016857.
9. Murphy DE, de Jong OG, Brouwer M et al. Extracellular vesicle-based therapeutics: natural versus engineered targeting and trafficking. Exp Mol Med 2019; 51(3): 1-12. doi:10.1038/s12276-019-0223-5.
10. Koh HB, Kim HJ, Kang SW, Yoo TH. Exosome-based drug delivery: translation from bench to clinic. Pharmaceutics 2023; 15(8): 2042. doi:10.3390/pharmaceutics15082042.
11. Ghosh S, Ghosh S. Exosome: The “Off-the-shelf” cellular nanocomponent as a potential pathogenic agent, a disease biomarker, and neurotherapeutics. Front Pharmacol 2022; 13: 878058. doi:10.3389/fphar.2022.878058.
12. Gong L, Tian L, Cui K et al. An off-the-shelf small extracellular vesicle nanomedicine for tumor targeting therapy. J Control Release 2023; 364: 672-686. doi:10.1016/j.jconrel.2023.11.013.
13. Herrmann IK, Wood MJA, Fuhrmann G. Extracellular vesicles as a next-generation drug delivery platform. Nat Nanotechnol 2021; 16(7): 748-759. doi:10.1038/s41565-021-00931-2.
14. Kar R, Dhar R, Mukherjee S et al. Exosome-based smart drug delivery tool for cancer theranostics. ACS Biomater Sci Eng 2023; 9(2): 577-594. doi:10.1021/acsbiomaterials.2c01329.
15. Sharma V, Mukhopadhyay CD. Exosome as drug delivery system: current advancements. Extracellular Vesicle 2024; 3:100032. doi:10.1016/j.vesic.2023.100032.
16. Samaeekia R, Rabiee B, Putra I et al. Effect of human corneal mesenchymal stromal cell-derived exosomes on corneal epithelial wound healing. Invest Ophthalmol Vis Sci 2018; 59(12): 5194-5200. doi:10.1167/iovs.18-24803.
17. Desjardins P, Berthiaume R, Couture C et al. Impact of exosomes released by different corneal cell types on the wound healing properties of human corneal epithelial cells. Int J Mol Sci 2022; 23(20): 12201. doi:10.3390/ijms232012201.
18. Ong HS, Riau AK, Yam GH et al. Mesenchymal stem cell exosomes as immunomodulatory therapy for corneal scarring. Int J Mol Sci 2023; 24(8): 7456. doi:10.3390/ijms24087456.
19. Pacienza N, Lee RH, Bae EH et al. In vitro macrophage assay predicts the in vivo anti-inflammatory potential of exosomes from human mesenchymal stromal cells. Mol Ther Methods Clin Dev 2018; 13: 67-76. doi:10.1016/j.omtm.2018.12.003.
20. Malvicini R, Santa-Cruz D, De Lazzari G et al. Macrophage bioassay standardization to assess the anti-inflammatory activity of mesenchymal stromal cell-derived small extracellular vesicles. Cytotherapy 2022; 24(10): 999-1012. doi:10.1016/j.jcyt.2022.05.011.
21. Malvicini R, Santa-Cruz D, Tolomeo AM, Muraca M, Yannarelli G, Pacienza N. Ion exchange chromatography as a simple and scalable method to isolate biologically active small extracellular vesicles from conditioned media. PLoS One 2023; 18(9): e0291589. doi:10.1371/journal.pone.0291589.
22. Su Y, Chen M, Xu W, Gu P, Fan X. Advances in extracellular-vesicles-based diagnostic and therapeutic approaches for ocular diseases. ACS Nano 2024; 18(34): 22793-22828. doi:10.1021/acsnano.4c08486.
23. Yannarelli G, Pacienza N, Cuniberti L, Medin J, Davies J, Keating A. Brief report: the potential role of epigenetics on multipotent cell differentiation capacity of mesenchymal stromal cells. Stem Cells 2013; 31(1): 215-220. doi:10.1002/stem.1262.
24. Dominici M, Le Blanc K, Mueller I et al. Minimal criteria for defining multipotent mesenchymal stromal cells: the International Society for Cellular Therapy position statement. Cytotherapy 2006; 8(4): 315-317. doi:10.1080/14653240600855905.
25. Shadmani A, Dhowre HS, Ercal O, Meng XQ, Wu AY. Corneal and limbal alkali injury induction using a punch-trephine technique in a mouse model. J Vis Exp 2023; (198): 10.3791/65609. doi:10.3791/65609.
26. Domínguez LM, Bueloni B, Cantero MJ et al. Chromatographic scalable method to isolate engineered extracellular vesicles derived from mesenchymal stem cells for the treatment of liver fibrosis in mice. Int J Mol Sci 2023; 24(11): 9586. doi:10.3390/ijms24119586.