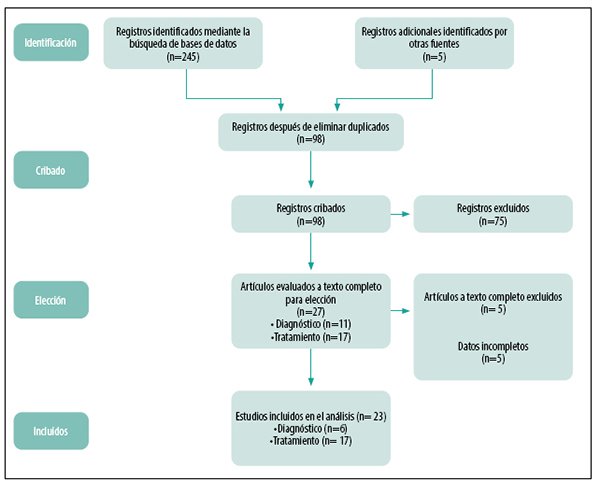
Figura 1. Diagrama de flujo para la inclusión de los estudios en la revisión sistemática según las recomendaciones PRISMA.
ARTÍCULO ORIGINAL
Metástasis coroideas: diagnóstico y tratamiento local (revisión sistemática)
Andreas Di Lucianoa, b, Agustina Adaniyab, Virgilio Morales-Cantóna, Emiliano Becerrac, Vidal Soberóna
a Departamento de Retina, Asociación para Evitar la Ceguera en México, IAP, Ciudad de México.
b Latin America Network of Research in Eye Diseases (LANRED).
c Práctica privada, Neuquén, Argentina.
Autor corresponsal
Dr. Andreas Di Luciano R.
andreasdilu@gmail.com
Oftalmol Clin Exp (ISSN 1851-2658)
2021; 14(1): 9-22.
Protección de personas y animales
Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos
Los autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informado
Los autores declaran que en este artículo no aparecen datos de pacientes.
Financiamiento
Los autores no recibieron patrocinio para llevar a cabo este artículo.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
RESUMEN
Objetivo: Realizar una revisión sistemática sobre los métodos diagnósticos y los tratamientos locales en metástasis coroideas.
Materiales y métodos: Se hizo una búsqueda sistemática siguiendo las recomendaciones PRISMA en las bases de datos de Pubmed y EMbase de documentos publicados hasta junio de 2020 y utilizando las palabras clave: “choroidal metastasis”, “choroidal metastasis treatment”, “choroidal metastases diagnosis”, “choroidal metastasis treatment”, “external beam radiotherapy”, “proton beam therapy”, “transpupillary thermotherapy”, “photodynamic therapy” e “intravitreal inyection”. Criterios de inclusión: estudios de cohortes y series de casos sin límite por número de ojos con pacientes con diagnóstico de metástasis coroideas y documentación completa de la enfermedad. Se excluyeron estudios duplicados e incompletos.
Resultados: Se encontró un total de 245 artículos tanto en la búsqueda combinada como dirigida, de los cuales se utilizaron 7 para analizar las características diagnósticas y 17 para analizar los tipos de tratamientos locales. Referente a los métodos diagnósticos, se incluyeron artículos publicados entre los años 1985 y 2014; el 100% estaba constituido por estudios tipo cohorte retrospectivos o series de casos. Los estudios referentes a los tratamientos locales fueron publicados entre los años 1977 y 2016; la mayoría de los estudios fueron series de casos retrospectivos intervencionales, series de casos y reporte de casos.
Conclusiones: A pesar de la mejoría en sus métodos, el diagnóstico sigue siendo esencialmente clínico. Se describe una gran variedad de clases de tratamientos locales; sin embargo, no existen a la fecha algoritmos de tratamiento y la terapéutica debe individualizarse.
Palabras clave: metástasis coroideas, diagnóstico, tratamientos locales.
Choroidal metastases: diagnosis and local treatments (a systematic review)
ABSTRACT
Objetives: To carry out a systematic review on diagnostic methods and local treatments for the treatment of choroidal metastasis
Material and methods: A systematic search was carried out following the PRISMA recommendations using Pubmed and Embase databases, of articles published up to June 2020. The keywords used were: “choroidal metastasis”, “treatment of choroidal metastasis”, “Diagnostic choroidal metastasis”, “treatment of choroidal metastases”, “external beam radiation therapy”, “proton beam therapy”, “transpupillary thermotherapy”, “photodynamic therapy” and “intravitreal injection”. Inclusion criteria: cohort studies and case series without limit by number of without limit by number of eyes, with patients with a diagnosis of choroidal metastases and complete documentation of the disease. Duplicate and incomplete studies were excluded.
Results: A total of 245 articles were found both in the combined and directed searches, of which 7 were used to analyze the diagnostic characteristics and 17 to analyze the types of local treatments. Regarding diagnostic methods, articles published between 1985 and 2014 were included, 100% were retrospective cohort studies or case series. The studies referring to local treatments were published between 1977 and 2016, most of the studies were interventional retrospective case series, case series and case reports.
Conclusions: Despite the improvement in diagnostic methods, the diagnosis remains clinical. A great variety of types of local treatments are described, however, there are no treatment algorithms to date and the treatments must be individualized.
Keywords: choroidal metastases, diagnosis, local treatments.
Metástases coroidais: diagnóstico e tratamento local (revisão sistemática)
RESUMO
Objetivo: Realizar uma revisão sistemática sobre métodos diagnósticos e tratamentos locais nas metástases da coróide.
Materiais e métodos: Realizou-se uma busca sistemática seguindo as recomendações PRISMA nas bases de dados Pubmed e EMbase de documentos publicados até junho de 2020 e usando as palavras-chave: “choroidal metastasis”, “choroidal metastasis treatment”, “choroidal metastases diagnosis”, “choroidal metastasis treatment”, “external beam radiotherapy”, “proton beam therapy”, “transpupillary thermotherapy”, “photodynamic therapy” e “intravitreal inyection”. Critérios de inclusão: estudos de coortes e séries de casos sem limite por número de olhos com pacientes com diagnóstico de metástases coroidais e documentação completa da doença. Estudos duplicados e incompletos foram excluídos.
Resultados: Foram encontrados 245 artigos tanto nas buscas combinadas quanto nas direcionadas, dos quais 7 foram utilizados para analisar as características diagnósticas e 17 para analisar os tipos de tratamentos locais. Em relação aos métodos diagnósticos, foram incluídos artigos publicados entre 1985 e 2014; 100% consistia em estudos de coorte retrospectivos ou séries de casos. Os estudos referentes aos tratamentos locais foram publicados entre 1977 e 2016; A maioria dos estudos foram séries de casos intervencionais retrospectivos, séries de casos e relatos de casos.
Conclusões: Apesar do aprimoramento de seus métodos, o diagnóstico permanece essencialmente clínico. Descrevem-se uma grande variedade de tipos de tratamentos locais; no entanto, não há algoritmos de tratamento até o momento e a terapia deve ser individualizada.
Palavras chave: metástases coroidais, diagnóstico, tratamentos locais.
INTRODUCCIÓN
Las metástasis coroideas (MC) son el tumor maligno intraocular más frecuente1. Su frecuencia se ha ido incrementando debido al aumento en la expectativa de vida y la mejoría de los métodos diagnósticos1-2. Las MC son tumores de pobre pronóstico ya que desde el diagnóstico la sobrevida presenta una media de 6 a 9 meses10-12. El rol del oftalmólogo es fundamental en la pesquisa de este tipo de tumores porque un diagnóstico y una derivación oportuna pueden influir positivamente tanto en el pronóstico y tratamiento así como en la calidad visual y de vida de estos pacientes. A la fecha el diagnóstico es clínico, pero es de suma importancia apoyarse en los métodos de exploración imagenológica para hacer un adecuado diagnóstico diferencial. El tratamiento es multidisciplinario y dependerá de múltiples factores como lo son el estadio tumoral, la localización, la lateralidad y el estado general del paciente3-4. La terapia de elección es la sistémica pero se describen múltiples tratamientos locales que buscan preservar la visión y el globo ocular. En la literatura se describen múltiples terapéuticas locales con buenos resultados4. Debido a esto surge la necesidad de evaluar los resultados de estos tratamientos a través de un análisis sistemático para valorar las ventajas y desventajas de cada uno de ellos.
MATERIALES Y MÉTODOS
Estrategia de búsqueda y selección de estudios
Se realizó una búsqueda sistemática en las bases de datos de Pubmed y Embase de documentos publicados hasta junio de 2020, utilizando las siguientes palabras clave: choroidal metastasis, choroidal metastasis treatment, choroidal metastasis diagnosis, external beam radiotherapy, proton beam therapy, transpupillary thermotherapy, photodynamic therapy e intravitreal injection. Adicionalmente, se revisó la lista de referencias de los estudios identificados y de las revisiones relevantes en el tema buscando otros posibles trabajos que pudieran incluirse.
Se incorporaron estudios de cohortes y series de casos sin límite por número de ojos, con pacientes con diagnóstico de metástasis coroideas y documentación completa de la enfermedad. Se excluyeron estudios duplicados y con datos incompletos. Referente al idioma, se utilizaron estudios en español e inglés y no hubo limitación por fecha de publicación. La selección de los estudios se realizó de forma independiente por dos investigadores (AD y AA); las diferencias fueron resueltas por un tercer investigador (VS).
En la figura 1 se presenta un esquema que resume la estrategia utilizada y las tareas desarrolladas en esta revisión sistemática, que se realizó siguiendo las recomendaciones de las normas PRISMA.

Figura 1. Diagrama de flujo para la inclusión de los estudios en la revisión sistemática según las recomendaciones PRISMA.
Extracción de datos y análisis
Los estudios encontrados fueron exportados al software EndNote X9 para eliminación de artículos duplicados y subsecuentemente importando a Number v6.1 6369 para su tabulación se subdividió en diagnóstico y tratamiento. Los datos extraídos de los estudios en forma general fueron: autor principal, año de publicación, metodología de estudio y número de ojos. Para los estudios diagnósticos se incluyó tipo de estudio diagnóstico y resultados. Referente a los estudios que abarcan el tratamiento se incluyó el tipo de tratamiento y los resultados en cuanto a regresión tumoral y agudeza visual mejor corregida (AVMC).
Los datos extraídos fueron revisados por dos investigadores de forma independiente (AD y AA). Al existir alguna observación sobre uno de los estudios fue evaluado una vez más por otro investigador (EB). La revisión fue evaluada una vez más por expertos en el tema (EB y VS) antes de crear el manuscrito final.
RESULTADOS
Se encontró un total de 245 artículos tanto en la búsqueda combinada como dirigida, de los cuales se utilizaron 7 para analizar las características diagnósticas y 17 para analizar los tipos de tratamientos locales.
Referente a los métodos diagnósticos, se incluyeron artículos publicados entre los años 1985 y 2014, el 100% eran estudios tipo cohorte retrospectivos o series de casos, y los métodos utilizados fueron ultrasonido (US) (n=2), tomografía de coherencia óptica con imagen de profundidad mejorada (EDI-OCT) (n=3) y angiografía con fluoresceína (AGF) (n=1) (tabla 1).
Tabla 1. Revisión sistemática de métodos diagnósticos
Autor y año |
Tipo de estudio |
Población |
Método diagnóstico principal |
Resultados |
Verbeek et al. (1985)23 |
Cohortes retrospectivo |
29 ojos con MC. |
US |
Reflectividad media a baja (modo A) |
Sobottka et al. (1999)22 |
Cohortes retrospectivo |
16 ojos con MC |
US |
Menor relación de radio base altura (modo B) |
Arévalo et al. (2005)25 |
Cohortes retrospectivo |
7 ojos con MC. |
EDI-OCT |
Desplazamiento anterior de fotorreceptores. |
Li et al. (2011)20 |
Cohortes retrospectivo |
23 ojos con MC. |
AGF |
Hipofluorescencia en FA e hiperfluorescencia en aumento. |
Al-Dahmash et al. (2014)26 |
Cohortes retrospectivo |
14 ojos con MC. |
EDI-OCT |
93% obliteración/compresión CC. |
Demirci et al. (2014)38 |
Cohortes retrospectivo |
24 ojos con MC de un tamaño menor o igual a 2.5 mm. (US) |
EDI-OCT |
100% adelgazamiento de CC. |
Abreviaturas: |
MC: metástasis coroideas. US: ultrasonografía ocular. M: mujeres. H: hombres. EM: edad media. EDI-OCT: enhanced depth imaging optical coherence tomography. EPR: epitelio pigmentario de la retina. CC: coriocapilar. FR: fotorreceptores. AGF: angiografía con fluoresceína. FA: fase arterial. FAV: fase arteriovenosa. S: sensibilidad. E: especificidad. VPP: valor predictivo positivo. VPN: valor predictivo negativo. LSR: líquido subretinal. |
|||
Los estudios referentes a los tratamientos locales fueron publicados entre los años 1977 y 2016, la mayoría fueron series de casos retrospectivos intervencionales, series de casos y reporte de casos. Los tipos de tratamientos encontrados fueron radioterapia en placa (n=1), terapia con haz de protones/electrones (n=1), radioterapia de haz externo (EBRT) (n=3), termoterapia transpupilar (TTT) (n=2), terapia fotodinámica (TFD) (n=5) e inyecciones intravítreas (n=5). (tabla 2).
Tabla 2. Revisión sistemática de tratamiento
Autor y año |
Tipo de estudio |
Población |
Método de tratamiento |
Resultados |
Chu et al. (1977)33 |
Cohortes retrospectivo |
57 ojos con MC (ca. mama) |
Terapia con radiación (haz de electrones y de protones) |
Mejoría en AV 35%. |
Shields et al. (1997)34 |
Cohortes retrospectivo |
36 ojos con MC (ca. mama, pulmón, próstata, etc.) |
Radioterapia en placa |
La media en grosor del tumor al último control fue de 1.77 mm. Se encontró una regresión tumoral completa en el 47% e incompleta en un 47%. |
Rudoler et al. (1997)31 |
Cohortes retrospectivo |
188 ojos con MC. |
EBRT |
57% mejoría en AV o estabilidad tumoral. |
Demirci et al. (2003)43 |
Cohortes retrospectivo |
129 ojos con MC (ca. mama) |
EBRT |
64% de mejoría y un 18% de estabilidad tumoral. |
D’Abbadie (2003)44 |
Cohortes retrospectivo |
97 ojos con MC (ca. mama, pulmón) |
EBRT |
55% mejoría en AV a los 3 meses. |
Vianna et al. (2004)36 |
Reporte de caso |
1 ojo con MC (ca. mama). |
TTT |
100% de reabsorción de LSR y mejoría en AV. Seguimiento por 6 meses. |
Harbour et al. (2004)39 |
Reporte de caso |
1 ojo con MC (ca. pulmón) |
TFD |
25% de reducción del tamaño tumoral. |
Tsina et al. (2005)32 |
Cohortes retrospectivo |
76 ojos con MC. |
PBT |
84% regresión completa a los 5 meses de tratamiento. |
Soucek et al. (2006)40 |
Reporte de caso |
1 ojo con MC (ca. de mama) |
TFD |
100% regresión del tumor. |
Isola et al. (2006)41 |
Reporte de caso |
1 ojo con MC (ca. de mama) |
TFD |
Mejoría AV. |
Mauget-Faysse et al. (2006)42 |
Reporte de caso |
1 ojo con MC (ca. de mama) |
TFD |
Sin cambios en reducción tumoral. |
Amselem et al. (2007)45 |
Reporte de caso |
1 ojo con MC (por ca. de mama). |
Anti-VEGF |
Mejoría AV y regresión tumoral en un mes de seguimiento. |
Fabrini et al. (2009)46 |
Reporte de caso |
1 ojo con MC por ca. de tiroides |
Anti-VEGF |
Mejoría AV, regresión tumoral y disminución de LSR en 20 meses de seguimiento. |
Romanowska et al. (2011)35 |
Cohortes retrospectivo |
45 ojos con MC. |
TTT |
62.7% disminución del tamaño tumoral. |
Kaliki et al. (2012)37 |
Cohortes retrospectivo |
8 ojos con MC. |
TFD |
78% resolución de LSR. |
Mansour et al. (2012)48 |
Reporte de casos |
1 ojo con MC por ca. mama. |
Anti-VEGF |
Mejoría AV y regresión tumoral en 2 meses de seguimiento. |
Maudgil et al. (2015)47 |
Serie de casos |
5 ojo con MC. ca. pulmón (2); ca. mama (1) y ca. Intestino (2) |
Anti-VEGF |
Sin cambios en AV y 4 de 5 tumores progresaron independiente del tratamiento con anti-VEGF. Tiempo de seguimiento: 2 meses |
Boss et al. (2016)49 |
Serie de casos |
3 ojos |
Anti-VEGF |
Mejoría en AV, regresión tumoral y disminución de LSR en seguimiento de 3 meses. |
Abreviaturas: |
MC: metástasis coroideas. Ca: cáncer. AV: agudeza visual. G: grado. H: hombre. M: mujer. RT: radioterapia. EBRT: external beam radiotherapy. LSR: líquido subretinal. TTT: termoterapia transpupilar. PBT: proton beam therapy. TFD: terapia fotodinámica. |
|||
Sobre la eficacia de los diversos tratamientos —según los artículos incluidos—, la EBRT, con mayor cantidad de ojos evaluados, presentó tanto mejoría visual como regresión tumoral en el 58,7% (243/414 ojos). Mientras que los antiangiogénicos presentaron mejoría visual y regresión tumoral en 63,6% (7/11 ojos).
La TTT, en cambio, presentó regresión tumoral en 71,7% promedio (33/46 ojos) versus radioterapia en placa que obtuvo regresión tumoral completa en 47% (17/36 ojos).
Por último, los artículos que midieron sólo mejoría visual incluyen a la TFD, que presentó 83% de mejoría (10/12 ojos), en contraposición con la terapia por radiación que obtuvo mejoría de visión total o parcial en 57% (32/57 ojos) (tabla 3).
Tabla 3. Resumen del análisis global de los tratamientos en pacientes con metástasis, porcentaje de mejoría y regresión tumoral por grupo
Tratamiento |
Mejoría visual y/o regresión tumoral (%) |
EBRT (n=3) |
Mejoría AV y regresión tumoral |
TFD (n=5) |
Mejoría AV |
TTT (n=2) |
Regresión tumoral |
Anti-VEGF (n=5) |
Mejoría AV y regresión tumoral |
Terapia con radiación (protones y electrones) (n=1) |
Mejoría de AV total o parcial |
Radioterapia con placa (n=1) |
Regresión tumoral completa |
Desarrollo del tema
Epidemiología
Pearls comunicó el primer caso informado en la literatura en 18721. Las metástasis coroideas (MC) se consideran el tumor maligno intraocular más frecuente en adultos2. Su frecuencia se ha incrementado a consecuencia de un aumento en la sobrevida de los pacientes y a la mejoría en los métodos de diagnóstico3. La prevalencia de las metástasis intraoculares se han estudiado usando dos métodos: exámenes histopatológicos posmortem en pacientes que fallecieron de cáncer y examen clínico en pacientes vivos diagnosticados de MC. La prevalencia de metástasis estimada por estudios posmortem es de 4%-10% y en pacientes vivos a los cuales se realizó el diagnóstico clínico entre un 2%-7%3.
El sitio más frecuente de afectación es el tracto uveal presentándose en la coroides en un 85%, seguido del iris en un 9% y en tercer lugar en el cuerpo ciliar en un 2%4. El compromiso de la retina, del nervio óptico y del vítreo se consideran sitios excepcionales3-4.
Los tumores primarios más frecuentes son el cáncer de mama con un rango de 40%-53%, seguido del cáncer de pulmón con un 20%-29%3. Se describen en menor frecuencia cánceres provenientes del tracto gastrointestinal (4%), genitourinario (2%), próstata (2%), riñón (2%), cutáneo (2%) y tiroides3-5. Otros sitios reportados incluyen tumores provenientes de glándulas salivales, del tracto genital femenino6, tracto urotelial7 y tumores neuroendocrinos8. Si bien en la mayoría de los casos es posible encontrar el tumor primario, un estudio de Shields y colaboradores no encontró tumor primario en un 51% de los casos9.
La edad de diagnóstico de pacientes con MC varía entre 51 y 59 años y afecta más a las mujeres (70%-85%) que a los hombres debido al hecho de que el cáncer de mama es la causa más común de metástasis uveales10.
El tiempo entre el diagnóstico del cáncer primario y el desarrollo de MC varía entre una media de 12 y 55 meses10, 12. Este tiempo es menor para casos de cáncer de pulmón (media de 9.2 meses) si se compara con el cáncer de mama (media de 42.2 meses)11. En general, el pronóstico de estos pacientes es pobre con una sobrevida de 6 a 9 meses promedio10-12.
Cuadro clínico
Los síntomas principales en MC son la visión borrosa y el deterioro visual, que se explican en la mayoría de los casos por la aparición de un desprendimiento de retina exudativo en la región macular13. Los estudios muestran una frecuencia de un 55,2% para visión borrosa o baja visión. Otros síntomas también descritos pero en menor frecuencia son defectos del campo visual (15.6%), fotopsias (13.5%), metamorfopsias (11.5%), dolor ocular (11.5%) y flotadores vítreos en un 11.5%14. Existen reportes de casos que además han descrito diplopía y ojo rojo. La presencia de dolor asociado a un glaucoma neovascular secundario o a iritis es muy raro. Es importante subrayar que hasta un 13% de los pacientes puede encontrarse asintomático al momento del diagnóstico.
Al examen oftalmoscópico se presentan como lesiones cremosas de color blanquecino o amarillento (94%) que pueden o no estar asociadas a la presencia de líquido subretinal (LSR)9-11. El LSR se ve con una frecuencia de un 73%9. También se ha descrito una apariencia en forma de racimos de hiperpigmentación conocido como “piel de leopardo”14. Las alteraciones en el epitelio pigmentario de la retina (EPR) se describen en un 57%9. La forma de estas lesiones puede ser plana o sobreelevada en forma de domo. En menos de un 1% se ha descrito también forma en hongo9.
Referente al estudio de Shields en donde se evaluaron 520 ojos con metástasis uveales con compromiso coroideo, el tumor ocular fue encontrado en un 80% entre la mácula y el ecuador, en un 12% en el área macular y en un 8% en el ecuador9. El porcentaje de área comprometida a nivel de la retina es más frecuente el temporal (35%), superior (22%), inferior (17%), nasal (14%) y en mácula en un 12%9. En cuanto a las dimensiones del tumor, los tumores más grandes tenían una base promedio de 9 mm y un grosor de 3 mm9. Con respecto de la lateralidad y focalidad del tumor, las formas bilaterales y multifocales ocurren con mayor frecuencia en aquellas MC provenientes de carcinomas mamarios; en cambio, las formas unilaterales y unifocales son frecuentes en cáncer de pulmón2, 9-15.
Estudios complementarios
Si bien contamos con una amplia batería de exámenes imagenológicos complementarios, lo más importante es el alto índice de sospecha y la observación clínica detallada de las lesiones en manos de un observador con experiencia. El abordaje multimodal en oncología ha ido adquiriendo cada vez un papel más protagónico debido a que permite hacer un diagnóstico más preciso y favorece a la toma de decisiones terapéuticas17-19. Dentro de los exámenes auxiliares encontramos la fotografía del fondo de ojos, la ultrasonografía de alta resolución (US), la tomografía de coherencia óptica de dominio espectral (SD-OCT), la angiografía con fluoresceína (FAG), la autofluorescencia (AF) y angiografía con fluoresceína/verde de indocianina.
1. Fotografía del segmento anterior: la cámara con lámpara de hendidura (con o sin el uso de una lente gonioscópica). Se utiliza principalmente para documentar tumores que involucran la cámara anterior, el iris, el ángulo iridocorneal y el cuerpo ciliar, así como los tumores que involucran secundariamente estas estructuras para que puedan ser monitoreados a lo largo del tiempo18-19.
2. Fotografía de campo amplio (fig. 2): permite tener una imagen amplia de la localización, forma, extensión del tumor y de las características propias de cada tumor. Las cámaras de fondo de ojo de campo ultra amplio son las más populares en el área de la oncología ocular. Son fáciles de usar y producen imágenes de fondo de 200 grados con relativa facilidad18-19.
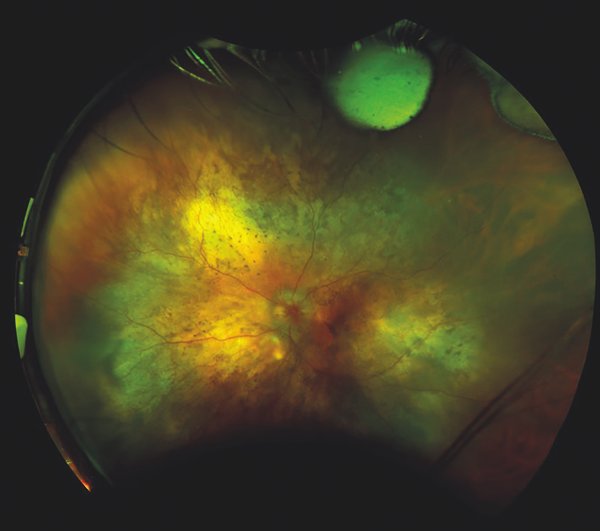
Figura 2. Fotografía de campo amplio. Paciente sexo femenino de 65 años con cáncer metastásico de mama con metástasis coroideas en su ojo izquierdo con compromiso del nervio óptico. Se observa pérdida de los márgenes del nervio óptico asociado a 3 lesiones sobreelevadas de borde mal definidos. Se observan cambios pigmentarios y aspecto en patrón de piel de leopardo.
3. Ultrasonografía de alta resolución (US) (fig. 3): determina la dimensión, ecogenicidad y permite diferenciar metástasis de otros tumores intraoculares. Cobra vital importancia en el diagnóstico diferencial con el melanoma coroideo. Los melanomas coroideos, a diferencia de las MC, se observan en el modo-A con una reflectividad media-baja y en el modo B son acústicamente huecos. En contraste, las MC presentan una mayor reflectividad en modo-A y se identifican como una masa plana o en forma de domo con eco densos en modo-B, con una altura significativamente menor en relación a la base en comparación con los melanomas2-23.
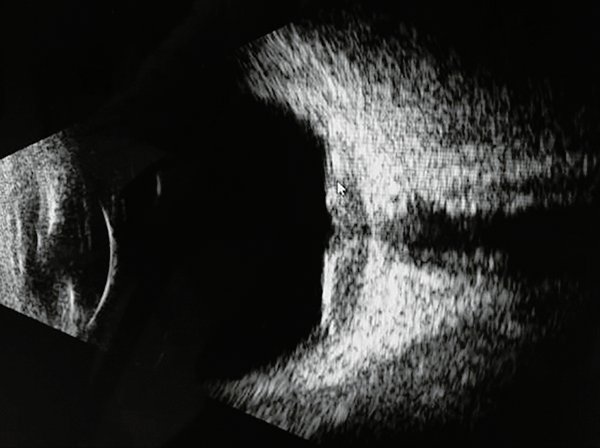
Figura 3. Ecografía modo B. Se observa masa homogénea, de aspecto sólido.
4. Tomografía de coherencia óptica de dominio espectral (SD-OCT) (fig. 4): la mayoría de las MC están localizadas a nivel del ecuador o a nivel de polo posterior. Teniendo en consideración que su grosor promedio es de 3 mm permiten poder ser estudiadas utilizando OCT24-25. Al-Dahmash y colaboradores investigaron 31 ojos de pacientes con MC usando EDI-OCT. Encontraron que de estos sólo el 45% pudo ser estudiado adecuadamente. Esto se debe al tamaño y la localización del tumor, ya que los de menor tamaño y los más periféricos son más difíciles de caracterizar. Las características más distintivas encontradas fueron: compresión anterior de la coriocapilar en un 93%; imagen de sombra posterior en un 86% y contorno anterior irregular (lumpy bumpy) en un 64%. Otras características reportadas fueron anormalidades del EPR en un 78%. Describiendo más específicamente pérdida a nivel estructural se encontraron alteraciones en las siguientes capas: capa de interdigitación (64%), en la porción elipsoide de los fotorreceptores (57%), membrana limitante externa (29%), capa nuclear externa (7%), capa plexiforme externa (7%). Las capas de la retina interna se encontraban normales. La presencia de LSR se encontró hasta en un 79% y se describen además la existencia de lipofuscina subretinal (7%) y edema intrarretinal en un 14%24-26.
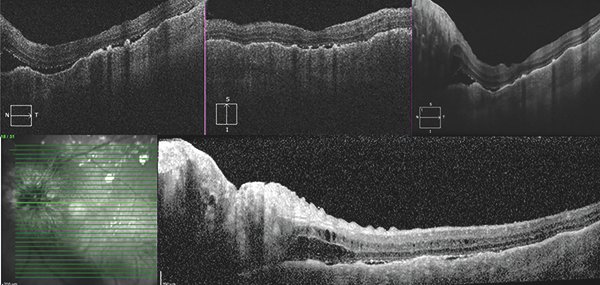
Figura 4. SD-OCT (Heidelberg, Zeiss). Macular cube 512 x 128. A) Corte de orientación naso-temporal donde se observa compresión de la coriocapilar asociado a sombra posterior, líquido subretinal, contorno anterior irregular (lumpy bumpy) y alteración a nivel de la capa de fotorreceptores tipo Shaggy. B) Corte de orientación ínfero-superior donde se observan las mismas características ya informadas en la imagen A. C) Corte a nivel del nervio óptico donde se observa líquido subretinal, contorno anterior irregular, una importante hiperreflectividad a nivel del nervio óptico con sombra acústica posterior. D) En mayor detalle es posible observar la afectación de coroides, retina y del nervio óptico.
5. Angiografía con fluoresceína (AGF) (fig. 5) y con verde de indocianina: provee información auxiliar para hacer diagnóstico diferencial con melanomas coroideos. Típicamente se presenta con una hipofluorescencia en fase arterial temprana con una hiperfluorescencia en fase venosa tardía. Habitualmente esta hiperfluorescencia es más tardía que en casos de melanomas coroideos. También es posible observar capilares retinales dilatados con una hiperfluorescencia por escape en el borde del tumor en un 73% de los casos2-20. La angiografía con verde de indocianina permite hacer el diagnóstico diferencial con tumores coroideos y además nos habilita un área de visualización mayor que la AGF. Por otro lado, se describe el patrón en doble circulación que ayuda a diferenciar una metástasis coroidea de un melanoma coroideo3-21.

Figura 5. Angiografía con fluoresceína. Mismo ojo de la paciente de la fig. 2. En fases tempranas se observa defecto de llenado por bloqueo e hiperfluorescencia temprana por fuga. En fases A-V se observan zonas hiperfluorescentes de fuga que aumentan a medida que avanza el angiograma acompañado con zonas hipofluorescente en aspecto de piel de leopardo.
6. Resonancia nuclear magnética: desde las descripciones de Peyster y colaboradores se describen las metástasis coroideas como imágenes isointensas en T1 e hipointensas en T227, 29. Similares características fueron reportadas por Shields y colaboradores en tres casos de tumores neuroendocrinos de pulmón27.
7. Aspiración con aguja fina: se recomienda en casos de tumor primario no identificado y puede dar información de evidencia de tumor primario versus metástasis30.
Tratamiento
El tratamiento tiene un abordaje multidisciplinario y dependerá del estadio tumoral, del estado sistémico del paciente y del número de tumores coroideos, su ubicación y su lateralidad2. En casos de pacientes con mal pronóstico o estado sistémico pobre es recomendable la observación2. En la literatura se han descrito distintas modalidades de terapéutica: desde el tratamiento sistémico con quimioterapia, inmunoterapia u hormonoterapia9 hasta tratamientos locales con radioterapia de haz externo, radioterapia con haz de protones, radiocirugía con gamma knife, radioterapia en placa, termoterapia transpupilar (TTT), terapia fotodinámica (TFD) y el uso de anti-VEGF.
En relación con la radioterapia con haz externo, sus objetivos son mejorar la visión o al menos prevenir la ceguera y la enucleación. Rudoler y colaboradores reportaron una mejoría visual de un 57% en 89 pacientes y una tasa de preservación del globo ocular de un 98%31. Esta terapia no se encuentra exenta de complicaciones, reportándose cataratas, retinopatía por radiación, neuropatía óptica, queratopatía por exposición, neovascularización del iris y glaucoma de ángulo cerrado2-31. Similares resultados se encontraron otros autores variando el seguimiento (5,8 meses a 12 meses) y utilizando una dosis total entre 20-64 Gy43-44.
Referente a la radioterapia con haz de protones, Tsina y colaboradores, en un estudio en 49 ojos con metástasis coroidea con un seguimiento de 16 meses, encontraron una tasa de remisión de un 84% a los 5 meses de tratamiento. En cuanto a la agudeza visual, ésta mejoró en un 47% de los pacientes. Cabe mencionar que las características de los tumores tratados fueron en su mayoría en forma de domo, localizados en el polo posterior con una media de tamaño de 3.5 mm. Si bien la terapia tuvo buenos resultados tampoco estuvo exenta de complicaciones, destacando: madarosis, queratitis, síndrome del ojo seco, catarata, glaucoma neovascular, retinopatía por radiación, entre otros32.
Sobre la radiocirugía con cuchillo gamma, solo existen en la literatura reportes de casos que denotan una mejoría en un 63% en 57 ojos tratados con esta técnica2-33.
La radioterapia en placa es otro tratamiento que ha tenido buenos resultados. Shield y colaboradores en 1997 trataron 36 ojos con MC y encontraron un 100% de regresión tumoral con una mejoría visual en un 58%. Dentro de las complicaciones reportadas con esta técnica se encuentran retinopatía por radiación y neuropatía óptica34.
La TTT también se ha descrito como tratamiento para las metástasis coroideas. Romanowska y colaboradores describen disminución del tamaño del tumor en un 62.7%, inhibición del crecimiento tumoral en un 8.4% y progresión del mismo en un 6.7%35. Vianna y colaboradores reportaron la regresión de una MC que era única con el uso de TTT36.
La TFD se ha usado ampliamente para el tratamiento de otras entidades de la oncología ocular como lo son el melanoma y los hemangiomas coroideos. Existen varios informes de casos con reducción del tamaño tumoral y mejoría de AV40-42.
Kaliki y colaboradores comunicaron el uso de TFD en 9 ojos con metástasis coroideas encontrando una resolución del LSR en un 78%y una reducción tumoral en un 39%37.
El uso de la terapia intravítrea también fue descrita en casos de metástasis coroideas. A la fecha la mayoría de evidencia proviene del reporte de casos utilizando bevacizumab en distintas dosis. La mayoría de estos pacientes ha sido tratada concomitantemente con quimioterapia u otra terapia local y se comunica mejoría visual, regresión y disminución del LSR45-46. Las dosis utilizadas varían entre 1.25 mg hasta 4 mg45 y el tiempo de seguimiento de estos pacientes va desde un mes hasta 20 meses46. No obstante, existe controversia en una serie de casos de Maudgil y colaboradores, quienes reportan falta de mejoría visual e incluso progresión tumoral en 4 de 5 casos tratados con bevacizumab 1.25 mg en seguimiento de 2 meses47.
DISCUSIÓN
Las metástasis coroideas son el tumor maligno intraocular más frecuente en adultos2. Su frecuencia se ha incrementado gracias al aumento en la sobrevida de los pacientes que las padecen. Representan un reto diagnóstico para el oftalmólogo ya que necesitan de un abordaje sistémico y multidisciplinario.
El diagnóstico es predominantemente clínico, haciendo uso de técnicas de exploración oftalmológica y apoyándose en estudios imagenológicos disponibles en la mayor parte de los centros oftalmológicos. Actualmente se recomienda hacer uso de la gran cantidad de estudios que están disponibles como OCT, angiografía con fluoresceína, fotos de fondo y ultrasonografía; cuanta más información se tenga de la masa a estudiar más fácil será llegar a un diagnóstico preciso. Características clínicas como múltiples masas coroideas con líquido subretinal son datos casi inequívocos de la presencia de metástasis coroideas. El uso de la ecografía ocular ha sido de utilidad para valorar las dimensiones del o de los tumores y al mismo tiempo poder realizar un diagnóstico diferencial con melanoma coroideo. Si bien se describen diferencias, aun así el diagnóstico es difícil. Desde el punto de vista ecográfico las características más importantes para diferenciarlo de un melanoma ocular son la reflectividad, que suele ser de media a baja en modalidad A y la presencia de un hueco acústico. Otro parámetro es la altura del tumor en relación con la base en la cual suele ser menor en metástasis coroideas2-23. Sobre el EDI-OCT hay varios estudios que han intentado determinar las características más frecuentes en este tipo de tumores. La mayoría de los estudios han utilizado el Heidelberg Spectralis. Las características más frecuente encontradas son: obliteración o compresión de la coriocapilar, capa de fotorreceptores elongadas e irregulares, presencia de LSR seguido de alteraciones a nivel del EPR y alteraciones estructurales en la capas interna y externa en la retina25-26, 38.
El hecho de que los pacientes con tumoraciones malignas oculares tengan un riesgo de perder la vida hace de suma importancia que el oftalmólogo esté listo para identificarlas, realizar un abordaje inicial eficiente y adecuado, y referenciar al paciente con el médico correcto puede ser la diferencia entre la vida y la muerte. Se estima que hasta el 30% de los pacientes con metástasis oculares no tenían un diagnóstico previo de malignidad, haciendo la intervención oftalmológica clave en la atención de ellos. Si bien es importante un abordaje multimodal, a la fecha ninguno de estos exámenes se considerado un gold standard y no reemplazan al diagnóstico clínico en manos de un observador experimentado junto con un abordaje sistémico multidisciplinario.
De no conocer la tumoración primaria, el abordaje debe de estar dirigido hacia las causas tumorales más comunes como mama, pulmón y gastrointestinales, adecuando las investigaciones al sexo, grupo de edad y síntomas del paciente. Los estudios de imágenes generales como PET-CT pueden ser de gran utilidad si se encuentran disponibles.
El tratamiento primario de estas tumoraciones es raro ya que se puede dividir a los pacientes en dos grandes grupos: los que responden bien al tratamiento sistémico y los que no. Los primeros suelen tener regresión tumoral de las masas coroideas y los segundos presentan un mal pronóstico para la vida. Sin embargo, gracias a los avances en quimioterapéuticos biológicos, un mayor número de pacientes se presenta en una categoría intermedia en la que tienen sobrevida aumentada sin regresión tumoral absoluta. Es en este grupo de pacientes donde se opta por un tratamiento adyuvante para la masa coroidea. Dentro de los tratamientos locales tenemos: radioterapia de haz externo (EBRT), radioterapia con haz de protones, radiocirugía con cuchillo gamma, radioterapia en placa, TTT, TDF y el uso de anti-VEGF.
La EBRT en caso de metástasis coroidea parece tener buenos resultados, si bien en esta revisión no hemos encontrado algún estudio aleatorio que sea comparado con otro tipo de tratamiento local2.
Tomando en consideración los trabajos analizados se encuentra una mejoría en la agudeza visual y regresión tumoral en un 58.7%31, 43-44.
En relación con la terapia con haz de protones no hay mucha evidencia en la literatura, pero sí se han reportado cohortes retrospectivas intervencionales en donde suele dejar esta terapia para pacientes con larga expectativa de vida y tumores relativamente radiorresistentes o tumores unifocales. La mayor cohorte hasta la fecha encontró una regresión tumoral de un 84% a los 5 meses de tratamiento con 37% de mejoría o mantención en la AV32.
La radioterapia en placa se prefiere para aquellos tumores solitarios y quimiorresistentes. En el estudio con el mayor número de pacientes tratados a la fecha se encontró una regresión tumoral de un 47% con una recurrencia de un 6%34. Los tratamientos de radiación son los más efectivos para este grupo ya que se tiene buena respuesta y los efectos adversos son a largo plazo.
La TTT se describe como tratamiento con una regresión tumoral de un 71.7%, la mayoría en tratamiento complementario sistémico. Del análisis de los estudios, no existen hasta la fecha estudios aleatorios pero parece ser una opción viable para metástasis coroidea de tamaño mediano35-36.
La TFD también se ha descrito como tratamiento para este tipo de metástasis. Esta terapia parece ser más efectiva en el tratamiento de tumores retroecuatoriales con un grosor menor a 3 mm y un diámetro menor a 10 mm. Desde el punto de vista sintomático, la TFD parece mejorar la AV debido probablemente a una disminución del LSR. La mayoría de los estudios son series de casos intervencionales y con un número de pacientes que varía entre 1 a 10. Se describe una reducción tumoral de un 78% en la mayor serie de casos que encontramos37.
El uso de anti-VEGF es otro tratamiento que se describe. La mayoría de los estudios provienen de reportes de casos únicos usando bevazicumab en dosis que varían entre 1.25 mg hasta 4 mg. En contraste hay otras series sin resultados muy alentadores45-49. De igual manera como con la mayoría de los tratamientos descritos, se requieren mayores estudios con un mayor número de pacientes y con una mejor metodología para hablar de sus efectos en cuanto a regresión tumoral y mejoría visual.
Referente a las limitaciones del estudio estamos conscientes que debido a la heterogeneidad de los tipos de tratamiento no es posible realizar un metanálisis con el peso estadístico necesario, por ende nos centramos en la revisión sistemática. Producto de nuestros criterios de inclusión y metodología de estudio también estamos conscientes de que se hayan podido omitir otros trabajos relevantes. Para minimizar esto se realizó una revisión por tres autores por separado y luego en conjunto.
Dentro de las fortalezas encontramos que a la fecha no existe una revisión sistemática que agrupe en una forma ordenada y concisa los principales métodos diagnósticos y tratamientos locales en metástasis coroideas.
CONCLUSIONES
Lamentablemente, si bien hoy en día hay mayor oferta de tratamientos, las MC son de mal pronóstico con pobre sobrevida. Sin embargo, el diagnóstico temprano y el tratamiento oportuno pueden mejorar la calidad visual y de vida de estos pacientes. No existe un algoritmo de tratamiento hasta la fecha debido a la gran variedad de presentaciones por lo que debe ser individualizado para cada paciente, manteniendo muy en cuenta el pronóstico para la vida y la función visual del paciente.
REFERENCIAS
1. Perls M. Beitrage zur geschwulstlehere. Virchows Arch 1872; 1: 437-467.
2. Arepalli S, Kaliki S, Shields CL. Choroidal metastases: origin, features, and therapy. Indian J Ophthalmol 2015; 63: 122-127.
3. Mathis T, Jardel P, Loria O et al. New concepts in the diagnosis and management of choroidal metastases. Prog Retin Eye Res 2019; 68: 144-176.
4. Shields CL, McMahon JF, Atalay HT et al. Retinal metastasis from systemic cancer in 8 cases. JAMA Ophthalmol 2014; 132: 1303-1308.
5. Kiratli H, Tarlan B, Söylemezoğlu F. Papillary thyroid carcinoma: bilateral choroidal metastases with extrascleral extension. Korean J Ophthalmol 2013; 27: 215-218.
6. Krohn-Hansen D, Strøm EH, Charles SJ, Bakken KE. Carcinoma of the ovary with primary presentation in the choroid. Acta Ophthalmol Scand 1999; 77: 713-716.
7. Nabi G, Dadeya S, Dogra PN, Lal H. Eye metastasis form urothelial tumours. Int Urol Nephrol 2002; 34: 51-54.
8. Eagle RC Jr, Ehya H, Shields JA, Shields CL. Choroidal metastasis as the initial manifestation of a pigmented neuroendocrine tumor. Arch Ophthalmol 2000; 118: 841-845.
9. Shields CL, Shields JA, Gross NE et al. Survey of 520 eyes with uveal metastases. Ophthalmology 1997; 104: 1265-1276.
10. Kanthan GL, Jayamohan J, Yip D, Conway RM. Management of metastatic carcinoma of the uveal tract: an evidence-based analysis. Clin Exp Ophthalmol 2007; 6: 553-565.
11. Freedman MI, Folk JC. Metastatic tumors to the eye and orbit: patient survival and clinical characteristics. Arch Ophthalmol 1987; 105: 1215-1219.
12. Ratanatharathorn V, Powers WE, Grimm J et al. Eye metastasis from carcinoma of the breast: diagnosis, radiation treatment and results. Cancer Treat Rev 1991; 18: 261-276.
13. Konstantinidis L, Damato B. Intraocular metastases: a review. Asia Pac J Ophthalmol (Phila) 2017; 6: 208-214.
14. Konstantinidis L, Rospond-Kubiak I, Zeolite I et al. Management of patients with uveal metastases at the Liverpool Ocular Oncology Centre. Br J Ophthalmol 2014; 98: 92-98.
15. Demirci H, Shields CL, Chao AN, Shields JA. Uveal metastasis from breast cancer in 264 patients. Am J Ophthalmol 2003; 136: 264-271.
16. Stoyukhina AS, Musatkina IV. Diagnostika khorioidal’nykh metastazov [Diagnostic approach to choroidal metastases]. Vestn Oftalmol 2016; 132: 66-81.
17. Kaur G, Anthony SA. Multimodal imaging of suspicious choroidal neoplasms in a primary eye-care clinic. Clin Exp Optom 2017; 100: 549-562.
18. Seider MI, Damato BE. Imaging the intraocular tumor. Expert Rev Ophthalmol 2014; 9: 387-399.
19. Di-Luciano A, Adaniya A, Morales-Cantón V et al. Melanoma coroideo: revisión sistemática. Oftalmol Clin Exp 2020; 13: 68-81.
20. Li L, Wang WJ, Chen RJ et al. [Fundus fluorescein angiography in metastatic choroidal carcinomas and differentiating metastatic choroidal carcinomas from primary choroidal melanomas]. Zhonghua Yan Ke Za Zhi 2011; 47: 27-34.
21. Shields CL, Shields JA, Kiratli H et al. Risk factors for growth and metastasis of small choroidal melanocytic lesions. Ophthalmology 1995; 102: 1351-1361.
22. Sobottka B, Kreissig I. Ultrasonography of metastases and melanomas of the choroid. Curr Opin Ophthalmol 1999; 10: 164-167.
23. Verbeek AM. Differential diagnosis of intraocular neoplasms with ultrasonography. Ultrasound Med Biol 1985; 11: 163-170.
24. Shields CL, Manalac J, Das C et al. Review of spectral domain enhanced depth imaging optical coherence tomography of tumors of the choroid. Indian J Ophthalmol 2015; 63: 117-121.
25. Arévalo JF, Fernández CF, García RA. Optical coherence tomography characteristics of choroidal metastasis. Ophthalmology 2005; 112: 1612-1619.
26. Al-Dahmash SA, Shields CL, Kaliki S et al. Enhanced depth imaging optical coherence tomography of choroidal metastasis in 14 eyes. Retina 2014; 34: 1588-1593.
27. Shields CL, Say EAT, Stanciu NA et al. Cavitary choroidal metastasis from lung neuroendocrine tumor: report of 3 cases. Arch Ophthalmol 2011; 129: 102-104.
28. Ward SD, Byrne BJ, Kincaid MC, Mann ES. Ultrasonographic evidence of a mushroom-shaped choroidal metastasis. Am J Ophthalmol 2000; 130: 681-682.
29. Peyster RG, Augsburger JJ, Shields JA et al. Intraocular tumors: evaluation with MR imaging. Radiology 1988; 168: 773-779.
30. Shields JA, Shields CL, Ehya H et al. Fine-needle aspiration biopsy of suspected intraocular tumors: the 1992 Urwick Lecture. Ophthalmology 1993; 100: 1677-1684.
31. Rudoler SB, Corn BW, Shields CL et al. External beam irradiation for choroid metastases: identification of factors predisposing to long-term sequelae. Int J Radiat Oncol Biol Phys 1997; 38: 251-256.
32. Tsina EK, Lane AM, Zacks DN et al. Treatment of metastatic tumors of the choroid with proton beam irradiation. Ophthalmology 2005; 112: 337-343.
33. Chu FC, Huh SH, Nisce LZ, Simpson LD. Radiation therapy of choroid metastasis from breast cancer. Int J Radiat Oncol Biol Phys 1977; 2: 273-279.
34. Shields CL, Shields JA, De Potter P et al. Plaque radiotherapy for the management of uveal metastasis. Arch Ophthalmol 1997; 115: 203-209.
35. Romanowska-Dixon B, Kowal J, Pogrzebielski A, Markiewicz A. [Transpupillary thermotherapy (TTT) for intraocular metastases in choroid]. Klin Oczna 2011; 113: 132-135.
36. Vianna RNG, Pena R, Muralha A et al. Transpupillary thermotherapy in the treatment of choroidal metastasis from breast carcinoma. Int Ophthalmol 2004; 25: 23-26.
37. Kaliki S, Shields CL, Al-Dahmash SA et al. Photodynamic therapy for choroidal metastasis in 8 cases. Ophthalmology 2012; 119: 1218-1222.
38. Demirci H, Cullen A, Sundstrom JM. Enhanced depth imaging optical coherence tomography of choroidal metastasis. Retina 2014; 34: 1354-1359.
39. Harbour JW. Photodynamic therapy for choroidal metastasis from carcinoid tumor. Am J Ophthalmol 2004; 137: 1143-1145.
40. Soucek P, Cihelkova I. Photodynamic therapy with verteporfin in subfoveal choroidal metastasis of breast carcinoma (a controlled case). Neuro Endocrinol Lett 2006; 27: 725-728.
41. Isola V, Pece A, Pierro L. Photodynamic therapy with verteporfin of choroidal malignancy from breast cancer. Am J Ophthalmol 2006; 142: 885-887.
42. Mauget-Faÿsse M, Gambrelle J, Quaranta-El Maftouhi M, Moullet I. Photodynamic therapy for choroidal metastasis from lung adenocarcinoma. Acta Ophthalmol Scand 2006; 84: 552-554.
43. Demirci, H, Shields CL, Chao AN, Shields JA. Uveal metastasis from breast cancer in 264 patients. Am J Ophthalmol 2003; 136: 264-271.
44. d’Abbadie I, Arriagada R, Spielmann M, Lê MG. Choroid metastases: clinical features and treatments in 123 patients. Cancer 2003; 98: 1232-1238.
45. Amselem L, Cervera E, Díaz-Llopis M et al. Intravitreal bevacizumab (Avastin) for choroidal metastasis secondary to breast carcinoma: short-term follow-up. Eye (Lond) 2007; 21: 566-567.
46. Fabrini MG, Genovesi-Ebert F, Perrone F et al. A multimodal approach to the treatment of bilateral choroidal metastases from thyroid carcinoma. Rare Tumors 2009; 1: e4.
47. Maudgil A, Sears KS, Rundle PA et al. Failure of intravitreal bevacizumab in the treatment of choroidal metastasis. Eye (Lond) 2015; 29: 707-711.
48. Mansour AM, Alameddine R. Intravitreal bevacizumab for consecutive multiple choroidal breast metastatic lesions. BMJ Case Rep 2012; 2012: bcr0320126124.
49. Boss JD, Lieu P, Tewari A. Effect of treatment of rectal cancer metastasis with intravitreal bevacizumab (Avastin) in patient with subretinal fluid and macular oedema: short-term follow-up. BMJ Case Rep. 2016; 2016: bcr2016216273.