ARTÍCULOS DE REVISIÓN
Coriorretinopatía central serosa
Ignacio Balparda y Daniel Colombero
Hospital Provincial del Centenario, Rosario, Argentina
Oftalmol Clin Exp (ISSNe 1851-2658)
2024; 17(3): e330-e351.
DOI:10.70313/2718.7446.v17.n03.342
Resumen
La coriorretinopatía central serosa es una patología ocular que afecta la mácula, se caracteriza por la acumulación de líquido subretinal y puede afectar la visión central y, de este modo, también modificar la calidad de vida de los pacientes. Se da por una descompensación en el epitelio pigmentario de la retina y cambios vasculares coroideos. Es una causa frecuente de pérdida de visión central que afecta principalmente a hombres de 20 a 60 años.
Hasta la fecha, no se ha llegado a un consenso sobre su clasificación y se ha propuesto una amplia variedad de intervenciones, lo que refleja la controversia asociada al tratamiento de esta enfermedad. La reciente publicación de ensayos controlados aleatorizados con un poder estadístico adecuado, así como grandes estudios retrospectivos no aleatorizados sobre su tratamiento, sugieren la viabilidad de un enfoque basado en la evidencia a la hora de considerar las opciones terapéuticas.
Se ha reportado la eficacia de muchas estrategias de tratamiento, como la terapia fotodinámica con verteporfina, los antagonistas de mineralocorticoides orales y el tratamiento con láser de micropulsos. Sin embargo, las pruebas disponibles actualmente sugieren que la terapia con láser de micropulsos y la terapia fotodinámica deberían ser el tratamiento de elección en la coriorretinopatía crónica, mientras que la conducta expectante puede ser el enfoque preferido en su manifestación aguda. No obstante, pueden considerarse excepciones en función de las características específicas de cada paciente.
Palabras clave: coriorretinopatía central serosa, terapia con láser de micropulsos, terapia fotodinámica con verteporfina.
Central serous chorioretinopathy
Abstract
Central serous chorioretinopathy is an ocular pathology that affects the macula and it is characterized by the accumulation of subretinal fluid, which can affect central vision and the quality of life of patients. It occurs due to a decompensation in the retinal pigment epithelium and choroidal vascular changes. It is a common cause of central vision loss that mainly affects men between 20 and 60 years old.
To date, no consensus has been reached on its classification, and a wide variety of interventions have been proposed, reflecting the controversy associated with the treatment of this disease. The recent publication of adequately powered randomized controlled trials, as well as large nonrandomized retrospective studies on its treatment, suggest the feasibility of an evidence-based approach when considering therapeutic options.
The efficacy of many treatment strategies has been reported, such as verteporfin photodynamic therapy, oral mineralocorticoid antagonists, and micropulse laser treatment. However, currently available evidence suggests that micropulse laser therapy and photodynamic therapy should be the treatment of choice in its chronic presentation, while observation may be the preferred approach in its acute manifestation. However, exceptions may be considered depending on the specific characteristics of each patient.
Keywords: central serous chorioretinopathy, micropulse laser therapy, verteporfin photodynamic therapy.
Coriorretinopatia serosa central
Resumo
A coriorretinopatia serosa central é uma patologia ocular que afeta a mácula, é caracterizada pela acumulacão de líquido sub-retiniano e pode afetar a visão central e, desta forma, modificar também a qualidade de vida dos pacientes. Ocorre devido a uma descompensação do epitélio pigmentar da retina e alterações vasculares da coróide. É uma causa comum de perda de visão central que afeta principalmente homens entre 20 e 60 anos.
Até à data, não foi alcançado consenso sobre a sua classificação e foi proposta uma grande variedade de intervenções, reflectindo a controvérsia associada ao tratamento deste problema. A recente publicação de ensaios clínicos randomizados com poder estatístico adequado, bem como grandes estudos retrospectivos não randomizados de seu tratamento, sugerem a viabilidade de uma abordagem baseada em evidências na hora de considerar opções terapêuticas. A eficácia de muitas estratégias de tratamento foi relatada, como terapia fotodinâmica com verteporfina, antagonistas mineralocorticóides orais e tratamento com laser micropulsado. Contudo, as evidências atualmente disponíveis sugerem que a terapia com laser de micropulsos e a terapia fotodinâmica devem ser o tratamento de escolha na coriorretinopatia crónica, enquanto a espera vigilante pode ser a abordagem preferida na sua manifestação aguda. Contudo, exceções podem ser consideradas dependendo das características específicas de cada paciente.
Palavras-chave: coriorretinopatia serosa central, terapia com laser de micropulsos, terapia fotodinâmica com verteporfina.
Introducción
La coriorretinopatía central serosa (CCS) está asociada con desprendimientos del epitelio pigmentario (DEP), disfunción del epitelio pigmentario de la retina (EPR) y engrosamiento coroideo con hiperpermeabilidad y sobrecarga venosa1. Se asocia con una o más áreas de fuga de la coroides a través de un defecto en la barrera hematorretinal externa del epitelio pigmentario de la retina2. Los pacientes a menudo presentan síntomas de visión borrosa, escotoma central, micropsia o metamorfopsia y aunque inicialmente se pensó que se trataba de una retinopatía primaria, estudios más recientes se han centrado en la patología de la coroides y el EPR1-2.
La CCS es relativamente frecuente y se considera la cuarta retinopatía no quirúrgica más común asociada a la pérdida de líquido (después de la degeneración macular asociada a la edad neovascular, el edema macular diabético y la oclusión venosa retinal)3.
Fue descrita por primera vez como “retinitis lútea central recidivante” por Albrecht von Graefe hace más de 150 años4. Según informa Rosen, en la década de 1940 Duke-Elder cambió el nombre de la enfermedad a “retinopatía serosa central”5.
La mayoría de los casos notificados en aquella época correspondía a reclutas militares de la Segunda Guerra Mundial; por lo tanto, la mayoría de los casos eran hombres jóvenes.
Ya entonces se hacía hincapié en el sistema nervioso autónomo. Por ejemplo, en 1955 Bennett informó de una alta incidencia de “enfermedades por estrés” y de antecedentes de situaciones vitales estresantes, así como de una “tensa constitución mental obsesiva” entre los pacientes afectados6.
Este trabajo tiene como objetivo revisar las principales características epidemiológicas, clínicas y fisiopatológicas de esta enfermedad; además de proporcionar una visión exhaustiva de la evidencia actual con respecto de las diversas intervenciones disponibles para el tratamiento de la coriorretinopatía central serosa (CCS), incluyendo la farmacológica, el tratamiento con láser y la terapia fotodinámica (TFD).
1. Epidemiología
Una gran cantidad de estudios individuales respaldan la idea de que los hombres se ven afectados con mayor frecuencia que las mujeres. Kitzmann y colaboradores llevaron a cabo el único estudio poblacional de cohortes y de casos y controles para determinar la epidemiología de la CCS. El estudio documentó todos los casos nuevos de CCS desde 1980 hasta 2002 e informó que la incidencia fue 6 veces mayor en hombres que en mujeres7. En un estudio realizado en la Argentina con 72 ojos —de los que 32 presentaban CCS aguda y 40 CCS crónica— la relación entre hombres y mujeres fue aproximadamente de 4:1 tanto en el grupo agudo como en el crónico8. En la literatura la información varía entre 2:1 y 9:1.
2. Características clínicas de la CCS
Se han propuesto varios subtipos de CCS, pero estos siguen siendo objeto de debate y actualmente no existe un sistema de clasificación universalmente aceptado. Este debate se basa en gran medida en el curso variable de la enfermedad y en las discrepancias con respecto de la clasificación de la CCS entre los oftalmólogos. Muchos autores utilizan una distinción básica entre la CCS aguda (CCSa) y crónica (CCSc) basada en la duración del líquido subretinal (LSR) y los cambios estructurales visibles en las imágenes multimodales.
Aunque el desprendimiento seroso en la CCSa suele resolverse en 3-4 meses sin necesidad de tratamiento, el desprendimiento tiende a persistir en la CCSc y la presencia crónica de LSR suele provocar daños estructurales permanentes en la retina neurosensorial y el EPR, con pérdida irreversible de visión a largo plazo9. En el sistema de clasificación CCSa/CCSc, la CCSa suele presentarse con una o pocas fugas focales y produce una elevación neurorretinal aislada en forma de cúpula (que no debe confundirse con un desprendimiento del EPR en forma de cúpula) con pocos cambios atróficos en el EPR. Por el contrario, los pacientes con CCSc pueden presentar un gran número de fugas y la fuga crónica de LSR tiende a producir un desprendimiento neurorretinal más grande y menos elevado.
Sin embargo, algunos pacientes presentan una o varias fugas que duran más de 4 meses pero que no se asocian con cambios generalizados del EPR. Por lo tanto, es discutible si este subgrupo clínico debe clasificarse como CCSa o CCSc. Dada esta amplia variación clínica, el progreso hacia un nuevo sistema de clasificación ha sido lento; sin embargo, alcanzar un consenso respecto de la clasificación es un primer paso importante para definir mejor los subgrupos de la enfermedad y los criterios de valoración de tratamiento.
Las subcategorías que se han propuesto incluyen la CCS no resolutiva, la CCS recurrente y la CCS inactiva, así como la CCS grave basada en imágenes multimodales. En esta revisión se utiliza la distinción básica entre CCSa y CCSc ya que es la más utilizada.
Se considera que los pacientes con un único punto de fuga tienen fuga focal, mientras que los pacientes con varios puntos de fuga o áreas mal delimitadas de colorante en la angiografía con fluoresceína (AF) pueden clasificarse como fuga difusa. Un punto de fuga focal en la AF temprana suele aumentar de tamaño con bordes difusos en la fase tardía debido a la fuga de fluoresceína a través del defecto focal en el EPR. Esta zona focal suele coincidir con un desprendimiento del EPR en forma de cúpula. Se supone que es el punto de menor resistencia en la barrera hematorretinal externa del EPR, consecuencia del aumento del gradiente de presión vascular de la coriocapilar. Como resultado de este pequeño desgarro en el EPR o defecto focal de la barrera hematorretinal externa, el líquido puede fluir desde debajo del EPR hacia el espacio subretinal.
Coriorretinopatía central serosa aguda (CCSa)
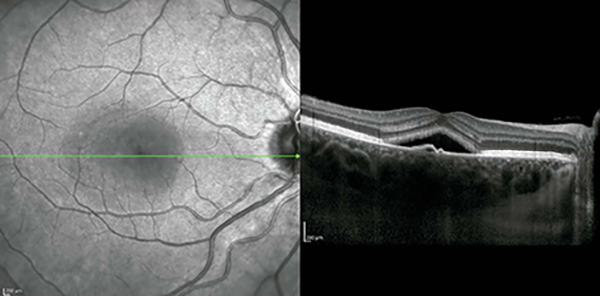
La CCS aguda se define como un desprendimiento seroso en forma de cúpula de la neurorretina de aparición aguda con resolución espontánea del LSR en 3-6 meses junto con un buen pronóstico visual (fig. 1).

Figura 1. Imagen típica de CCS en OCT. Se evidencia desprendimiento seroso en forma de cúpula.
Los pacientes con CCSa suelen presentar alteraciones de la visión e hipermetropización. En un estudio de 31 pacientes con CCSa el LSR se resolvió completamente a los 6 meses de seguimiento en el 84% de los pacientes10.
Curiosamente, algunas personas describen la duración de sus síntomas de solo unos días mientras que las imágenes pueden revelar indicios de enfermedad prolongada; por lo tanto, la duración de la enfermedad indicada por el paciente puede considerarse poco fiable. En el momento de la presentación se han identificado varios factores de riesgo para una duración prolongada de la CCS que pueden influir en la decisión de tratar o no. Estos factores de riesgo incluyen el grosor coroideo subfoveal > 500 μm, la altura del desprendimiento del epitelio pigmentario > 50 μm, presentación a los 40 años de edad o más10 y atrofia de fotorreceptores junto con restos granulares en el líquido subretinal en la OCT.
Sin embargo, se ha notificado que el LSR reaparece en hasta el 52% de los pacientes11. Lo que es más importante —incluso en pacientes que tuvieron LSR solo durante un breve período de tiempo— es que puede provocar daños irreversibles en los fotorreceptores; por lo tanto, el tratamiento también puede indicarse en casos de CCSa.
Los pacientes que presentan CCSa con grandes cantidades de LSR pueden ser más propensos a la pérdida de fotorreceptores en comparación con los que presentan cantidades relativamente pequeñas de LSR12.
Las características clásicas de la CCSa en la AF incluyen un defecto hiperfluorescente puntual del EPR con un área de hiperfluorescencia en ascenso a lo largo del tiempo, conocida comúnmente como “humo de chimenea”. Lo más habitual es que se produzca un patrón de fuga de “mancha de tinta” en el que la fuga focal que aparece durante el tránsito del colorante queda mal definida, ya que el colorante se filtra más lentamente en el espacio subretinal a través del defecto del EPR13. Los pacientes que presentan una fuga en chimenea en la AF pueden tener un desprendimiento seroso mayor en comparación con los pacientes con una fuga en mancha de tinta, lo que puede dar lugar a un aumento de la metamorfopsia. La localización del punto de fuga suele correlacionarse con un microdesgarro en el EPR14. En el CCSa, estos defectos se producen en ausencia de cambios atróficos difusos en el EPR. En las zonas en las que la AF muestra fugas focales, la angiografía con verde indocianina (AVI) puede revelar zonas de hiperpermeabilidad vascular coroidea, posiblemente dependiendo de si el tamaño del poro es lo suficientemente grande como para permitir el escape de las proteínas plasmáticas unidas al verde de indocianina. Además se ha observado en la autofluorescencia que las anomalías hipoautofluorescentes se correlacionan con áreas de fuga en la angiografía con fluoresceína, lo que podría explicar el rol del EPR en la fisiopatología, ya que la autofluorescencia refleja el estado estructural y funcional del EPR.
El volumen de LSR puede cuantificarse mediante tomografía de coherencia óptica (OCT) y un mayor volumen de LSR puede asociarse con una peor agudeza visual mejor corregida (AVMC). La presencia de puntos hiperreflectantes subretinales en la OCT puede representar macrófagos que contienen segmentos externos fagocitados, aunque también pueden representar proteínas plasmáticas de la coriocapilar y restos inflamatorios. Aunque se han observado cambios en la hemodinámica coroidea en el CCSa mediante flujometría de moteado láser, el grosor coroideo subfoveal no parece estar correlacionado con la cantidad de LSR. Por el contrario, la resolución del LSR y la AVMC en pacientes con CCSa parecen estar relacionadas con la velocidad del flujo sanguíneo coroideo macular y la velocidad del flujo disminuye a medida que se resuelve la CCSa.
La CCS sin resolución se ha descrito como una variante del CCSa en la que el LSR persiste durante más de 4 meses sin anomalías atróficas del EPR. Además, la recurrencia se ha definido como un episodio de CCSa seguido de uno o más episodios tras la resolución completa del LSR (figs. 2 y 3).
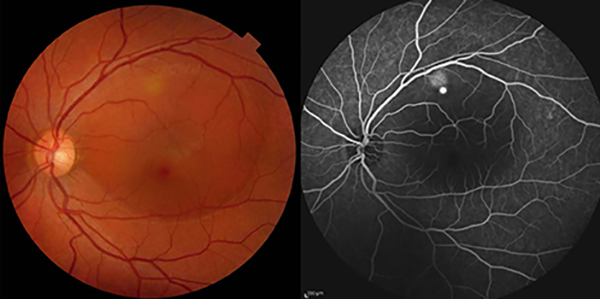
Figura 2. Paciente con CCSa. En la retinografía color se evidencia una sobreelevación bullosa macular. En la angiografía con fluoresceína: punto de filtración de contraste por debajo de la arcada temporal superior.
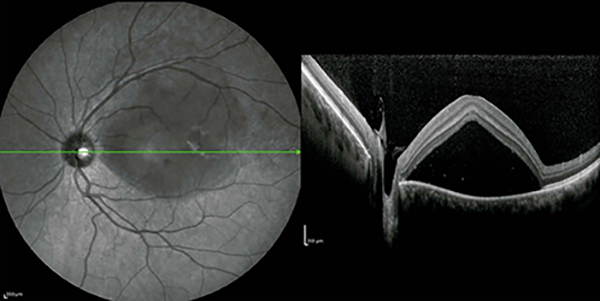
Figura 3. Mismo paciente de figura 3. Se evidencia desprendimiento de neuroepitelio central en forma de cúpula a la OCT.
Coriorretinopatía central serosa crónica (CCSc)
La CCS crónica se caracteriza por un desprendimiento seroso de la retina con áreas pequeñas o más extensas de desprendimiento del EPR, junto con cambios atróficos de la retina externa y el EPR. En la AF puede verse uno o más puntos de fuga; por otro lado, ciertas fugas pueden ser difíciles de evaluar en zonas de atrofia del EPR. Los pacientes suelen presentar desprendimientos serosos persistentes en la OCT durante más de 4-6 meses. Los ojos con CCS suelen manifestar anomalías generalizadas en la angiografía con verde de indocianina, incluyendo retraso en el llenado coroideo, venas coroideas dilatadas y/o hiperpermeabilidad vascular coroidea.
Relativamente pocos pacientes con CCSc tienen antecedentes de CCSa, lo que puede indicar diferencias clínicas significativas entre ambas. No se han descrito diferencias clínicas marcadas entre los pacientes con CCSc con fuga focal y aquellos con fuga difusa en autofluorescencia, lo que puede indicar que la coroides es la principal estructura implicada en ambas.
Los cambios atróficos difusos en el EPR pueden ser el resultado de episodios previos de CCS y de la presencia prolongada de LSR o puede ser el resultado de una disfunción coroidea subyacente que afecte directamente al EPR, por ejemplo, como se observa en la epiteliopatía pigmentaria paquicoroidea.
La progresión de los patrones de autofluorescencia FA en CCSc es lenta, tardando una media de 24 meses para que los cambios hipoautofluorescentes granulares progresen a un patrón confluente de hipoautofluorescencia (fig. 4)15.
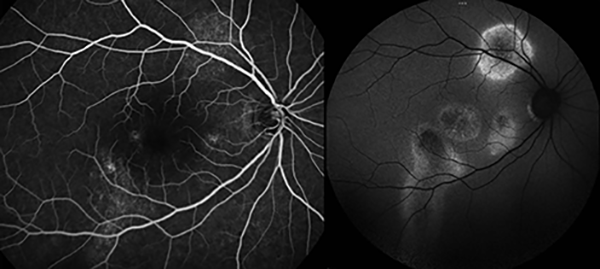
Figura 4. Paciente con CCSc. A la RFG se observa hiperfluorescencia difusa con varios puntos de fuga y signo de la corredera inferior. En la autofluorescencia aparecen zonas de hiper e hipoautofluorescencia coincidentes con el daño crónico de fotorreceptores.
En los casos de CCSc con cambios atróficos más marcados y/o extensos en el EPR, a menudo no presentan un DEP en forma de cúpula como en el CCSa; más bien, estos pacientes presentan un DEP poco profundo y más amplio que puede tener un componente neovascular subyacente. Este debe sospecharse en los casos en los que el espacio entre la DEP poco profunda y la membrana de Bruch en la OCT contiene material medianamente reflectante, presumiblemente neovascular, en lugar de ser hiporreflectante, que es más sugestivo de líquido. La OCT y la angiografía OCT (OCT-A) son útiles para identificar la neovascularización coroidea (NVC) sin el uso de la angiografía convencional (fig. 5).

Figura 5. Paciente con CCSc con varios sectores de desprendimiento de neuroepitelio plano.
Algunos casos de CCSc pueden complicarse con la acumulación de líquido cistoide dando lugar a una complicación denominada degeneración cistoide posterior de la retina (DCPR), en la que los cambios cistoides no afectan necesariamente a la mácula central, ya que suelen ser extrafoveales en diversas localizaciones del polo posterior.
Es importante destacar que se ha informado que la DCPR causa una pérdida grave de la visión central en algunos casos15. Los espacios intrarretinales cistoides pueden verse en la OCT, pero a diferencia del edema macular cistoide típico, no se tiñen en la AF. La DCPR se asocia a síntomas de CCSc que persisten más de 5 años. Puede producirse daño foveal y pérdida de visión debido al propio líquido intrarretinal así como al desprendimiento foveal asociado. En un estudio de 34 ojos con CCSc y DCPR, Cardillo Piccolino y sus colegas observaron que la agudeza visual oscilaba entre 20/20 y 20/400, con una agudeza visual de 20/40 o mejor en los ojos en los que el líquido intrarretinal no afectaba al centro foveal16. Mediante OCT-A, Sahoo y colaboradores detectaron NVC en casi la mitad de los casos (13 de 29 ojos) con degeneración macular cistoide. Los pacientes con CCSc a menudo experimentan una disminución gradual de la visión y de la sensibilidad al contraste debido a daños en fotorreceptores maculares; aproximadamente el 13% de estos ojos progresan a ceguera legal alcanzando una AV de 20/200 o peor después de 10 años17. Esta marcada pérdida de agudeza visual puede deberse a cambios atróficos del EPR en la fóvea central junto con daños en los fotorreceptores, degeneración macular cistoide y/o NVC secundaria.
Aunque los síntomas visuales en el CCSc suelen presentarse en un solo ojo, hasta el 42% de los pacientes con CCSc muestran signos de anomalías bilaterales. La CCS bilateral es relativamente más frecuente en pacientes de 50 años o más, con una prevalencia del 50% en este grupo de edad frente al 28% en pacientes menores de 50 años18.
3. Factores de riesgo
Por término medio, los hombres tienen entre 2 y 8 veces más probabilidades de desarrollar una CCS que las mujeres. El factor de riesgo externo más importante es el uso de corticosteroides. Aunque la razón precisa del efecto del uso de corticoides no esté claro, se ha notificado un aumento del grosor de la coroides y características de CCS en 1 de cada 18 pacientes tras el tratamiento con dosis altas de corticosteroides19. En raras ocasiones, incluso una exposición mínima a corticosteroides por vía intranasal, inhalatoria o extraocular se ha asociado a un mayor riesgo de CCS.
Yannuzzi informó de una asociación entre la CCS y el comportamiento de tipo A que tiene rasgos de personalidad que incluyen un impulso intenso y sostenido para lograr objetivos y un afán por competir, junto con un deseo de reconocimiento14. Otros componentes que se han señalado como parte del “perfil del paciente con CCS” son la impulsividad, la inestabilidad emocional y la agresividad, y se ha planteado la hipótesis de que todos ellos influyen en el riesgo de CCS. Curiosamente, se cree que los individuos con un comportamiento de tipo A tienen mayores niveles de corticosteroides y catecolaminas, lo que puede subyacer a un riesgo potencialmente mayor de desarrollar CCS. No obstante, para cuantificar y calificar el estrés se requerirán probablemente estudios sistemáticos a gran escala que incluyan evaluaciones psicométricas detalladas mediante cuestionarios adecuados y validados.
También se ha informado que el hipercortisolismo endógeno (es decir, el síndrome de Cushing) aumenta el riesgo de CCS. Además, varios estudios han encontrado un aumento de los niveles de cortisol en el suero de pacientes con CCS. La CCS puede ser un síntoma de presentación en el síndrome de Cushing y se informó que el LSR se resuelve en pacientes después de la cirugía para tratarlo. El embarazo también se ha asociado con un mayor riesgo de CCS junto con trastornos hipertensivos y vasculares. Aunque el grosor coroideo no parece cambiar durante un embarazo sano, sí puede aumentar en la preeclampsia y la hipertensión asociada también puede afectar a la circulación coroidea. La hiperpermeabilidad coroidea y la estasis en los vasos coroideos —que pueden ocurrir durante la preeclampsia— también pueden desempeñar un papel en el desarrollo del CCS durante el embarazo20.
Otros factores de riesgo asociados son los trastornos gastroesofágicos como la infección por Helicobacter pylori, la hipertensión sistémica no controlada, los antibióticos, el alcohol, las enfermedades respiratorias alérgicas, el nivel socioeconómico alto, el consumo de alcohol, el tabaquismo, las enfermedades coronarias, la apnea obstructiva del sueño, la mala calidad del sueño, las enfermedades autoinmunes y la hipermetropía; por el contrario, se observó que la miopía protege de la CCS. Con respecto de las enfermedades cardiovasculares, el mecanismo patogénico de las CCS puede residir en la disfunción general de las células endoteliales.
Algunos estudios informaron de una predisposición familiar a la CCS, lo que sugiere un componente genético. La CCS se ha asociado con los genes que codifican la susceptibilidad a la degeneración macular asociada a la edad 2, la cadherina 5 (CDH5), el receptor 2 del péptido intestinal vasoactivo (VIPR2) y el miembro 5 de la familia 7 de transportadores de solutos (SLC7A5)21.
4. Recurrencia y progresión de la enfermedad
Si no se trata, entre el 43% y el 51% de los pacientes con CCSa experimentan al menos una recurrencia. En pacientes con CCSc no tratado, la tasa de recurrencia a 1 año es entre el 30% y el 52%22. Se han identificado varios factores de riesgo para la recurrencia y la progresión de la enfermedad: el uso de corticosteroides, la hipertensión no tratada, una coroides subfoveal gruesa, hiperfluorescencia no intensa en la AF y la alteración del ritmo circadiano. Además, la depresión y los trastornos de ansiedad se han asociado con un mayor riesgo de recurrencia tanto en CCSa como en CCSc. El CCSc grave tiende a ser progresivo, aunque el tratamiento puede ralentizar la progresión de la enfermedad y estabilizar la agudeza visual.
5. Fisiopatología
a. Disfunción coroidea
Basándose en la evidencia clínica y en los hallazgos de la AF, Gass sugirió en 1967 que la hiperpermeabilidad y el aumento de la presión hidrostática en la coroides pueden inducir daños en el EPR, dando lugar posteriormente a una fuga por defecto en la barrera hemato-retinal externa del EPR generando un DEP o LSR con aumento de grosor coroideo y paquivasos.
La presencia de hiperfluorescencia coroidea en la AVI apoya la hipótesis de que la disfunción coroidea es el principal mecanismo patogénico subyacente. Otros cambios en la coroides apoyan aún más la noción de que las anomalías en la estructura y función coroideas desempeñan un papel fundamental en el desarrollo; estos cambios incluyen el aumento del grosor de la coroides, que puede disminuir tras el tratamiento, venas dilatadas en la capa de Haller, atrofia de las capas coroideas internas, aumento del índice de vascularidad coroidea y desregulación del flujo sanguíneo coroideo23.
Los procesos patológicos que contribuyen a las anormalidades coroideas observadas pueden incluir estasis coroidea, isquemia, inflamación y anomalías en el sistema del complemento12. Sin embargo, no es probable que la inflamación clásica dentro de la coroides desempeñe un papel en la CCS, ya que los corticosteroides pueden inducir o empeorar la enfermedad. Los procesos patológicos mencionados pueden provocar alteraciones del EPR, como DEP seroso, hiperplasia y atrofia, que pueden detectarse en AF y autofluorescencia.
Esta hipótesis está respaldada por los hallazgos en la OCT-A, que incluyen una mayor intensidad de la señal y una vasculatura coriocapilar más gruesa. Se ha informado de que el grosor coroideo varía a lo largo del día, lo que puede dar lugar a fluctuaciones diurnas en la cantidad de LSR que está presente en el CCS.
Existen diversos factores moleculares y fisiológicos que probablemente contribuyen a la hiperpermeabilidad coroidea y al desprendimiento seroso de la retina. Entre estos factores se incluyen la congestión/comprensión venosa vorticosa, la activación del receptor de mineralocorticoides, la desregulación de la vía del complemento, los procesos inflamatorios y/o el estrés oxidativo. Estos factores aumentan la permeabilidad de los vasos coroideos elevando la presión hidrostática, lo que puede causar directamente desprendimiento seroso de la retina y compresión de la coriocapilar. Esta compresión puede provocar isquemia, atrofia del epitelio pigmentario retinal (EPR) y un aumento de factores angiogénicos como el factor de crecimiento endotelial vascular, llevando a la formación de membranas neovasculares coroideas en la CCS24.
b. Congestión de venas vorticosas
El drenaje venoso de las estructuras retinales se realiza mediante venas vorticosas que drenan cuatro cuadrantes de la vasculatura coroidea y desembocan en las venas oftálmicas superiores. La obstrucción de las venas vorticosas, especialmente la vena vorticosa dominante que drena la mácula, puede contribuir al engrosamiento de los vasos de Haller y al desarrollo de SRF24.
Pang y colaboradores observaron la dilatación de una o más venas vorticosas en el 83,3% de los ojos con CCS mediante angiografía con indocianina de campo amplio, proponiendo que la congestión coroidea en estas venas puede causar la CCS25.
Brinks y colaboradores plantearon que las anastomosis arteriovenosas coroideas anormales pueden contribuir a la progresión de la CCS26. Estas anastomosis podrían eludir la coriocapilar, provocando el llenado arterial directo de las venas, el engrosamiento de las venas vorticosas y, finalmente, una sobrecarga venosa. Esta congestión del flujo sanguíneo en la coriocapilar podría resultar en un aumento de factores angiogénicos y la ruptura de la barrera del EPR. Así, el estudio de la hemodinámica de las venas vorticosas ha generado nuevos conceptos sobre la patogénesis de la CCS.
c. Engrosamiento escleral
El engrosamiento de la esclerótica puede obstruir mecánicamente el flujo venoso coroideo. Las venas vorticosas drenan a través de la esclerótica, penetrando 4 mm en el tejido. El aumento de la resistencia al flujo venoso puede deberse a la esclerótica engrosada, como ocurre en ojos hipermétropes. Estudios de imagen recientes han utilizado la OCT de fuente barrida del segmento anterior para determinar el grosor de la esclerótica. Imanaga et al. demostraron un aumento del grosor de la esclerótica anterior bajo el músculo recto en ojos con CCS en comparación con controles sanos en el primer estudio utilizando OCT de segmento anterior27. Fernández-Vigo et al. realizaron estudios similares que mostraron un aumento del grosor de la esclerótica anterior en CCS comparado con los controles28.
d. Cascada inflamatoria
El efecto de la inflamación en la coroides en la patogénesis de la CCS aún no se comprende completamente, especialmente debido a la relación entre la exposición a esteroides endógenos o exógenos y el desarrollo de CCS. Dado que los esteroides agravan la CCS, se considera que la inflamación causante podría ser insensible a los esteroides. Aunque algunos estudios han identificado niveles elevados de citocinas proinflamatorias —como la IL-6— en pacientes con CCS, no se ha establecido definitivamente un vínculo entre la CCS y la inflamación sistémica. Sin embargo, la hiperpermeabilidad y fuga coroidea observadas en la CCS han llevado a investigar más los marcadores inflamatorios en este proceso.
Estudios recientes han examinado marcadores séricos de inflamación como predictores del desarrollo o la gravedad de la CCS. Sirakaya et al. encontraron un aumento significativo en la relación de monocitos a lipoproteínas de alta densidad en pacientes con CCSa en comparación con controles sanos29. Por otro lado, Zola et al. estudiaron los niveles séricos de galectina 3, un marcador proinflamatorio, y encontraron una disminución significativa en pacientes con CCSa30. Un estudio de Bahadorani et al. en 2019 evaluó el papel de los agentes antiinflamatorios no esteroides tópicos en el tratamiento de la CCS e identificaron una disminución significativa en el grosor macular central y el LSR en ojos tratados con estos agentes comparado con los no tratados31.
e. Asociaciones genéticas
Varios casos de CCS familiar han sido reportados, lo que sugiere una asociación genética. Weenink et al. observaron que 14 de 27 familias de pacientes con CCS (52%) tenían al menos un pariente con múltiples áreas de atrofia del EPR o lesiones del fondo sugestivas de CCSc. Aunque no se ha establecido un patrón claro de herencia, Lehmann et al. encontraron que el 50% de los ojos de parientes de pacientes con CCS de cinco familias tenían una coroides más gruesa de 395 μm, sugiriendo que el paquicoroides podría ser una condición heredada con un posible patrón de transmisión dominante32.
La asociación de la CCS con el gen CFH ha sido bien documentada y algunos estudios han mostrado una asociación con la cadherina-5 (CDH5). La CDH5 se localiza en las uniones de células endoteliales, incluyendo aquellas en la coroides humana. La proteína codificada por el gen CDH5 es una glucoproteína de adhesión celular que se une al calcio y juega un papel importante en la biología de las células endoteliales controlando la cohesión y organización de las uniones intercelulares. La fosforilación o disminución de la expresión de ARNm se asocia con el desensamblaje de las moléculas de CDH5 y el aumento de la permeabilidad vascular. Variaciones genéticas en CDH5, combinadas con eventos desencadenantes como el tratamiento con corticosteroides, podrían explicar una proporción de casos de CCS en hombres. Schubert et al. concluyeron que la supresión inducida por esteroides de la expresión de CDH5 puede estar asociada con variaciones genéticas en el gen, resultando en la principal característica de esta enfermedad ocular común: la fuga de líquido en el espacio subretinal33.
f. Disfunción del EPR
El EPR desempeña un papel importante en la fisiopatología de la CCS. En un estudio se planteó la hipótesis de que las áreas focales de fuga a través del EPR subyacen a la acumulación de LSR, sugiriendo que los defectos en el EPR conducen a un flujo de salida de líquido hacia la coroides.
Sin embargo, hay pruebas abrumadoras de que los defectos en el EPR son presumiblemente secundarios a la disfunción coroidea, ya que las anomalías coroideas son más extensas que las anomalías del EPR —o al menos tan extensas como ellas— y la disfunción coroidea ha sido bien descrita utilizando AVI, OCT y OCT-A. Curiosamente, las anomalías del EPR también pueden estar presentes en el ojo no afectado en pacientes con CCS unilateral. La atrofia del EPR se asocia con una permeabilidad coroidea reducida que se observa como hipofluorescencia en AVI. Esto puede ser el resultado de la quiescencia progresiva de la coriocapilar después de una enfermedad de larga duración y de la atrofia crónica del EPR, ya que la secreción del factor de crecimiento endotelial vascular (VGEF) del EPR es necesaria para mantener la estructura normal y la homeostasis de la coriocapilar34.
El aumento de la presión hidrostática resultante en la coroides puede conducir a una reducción de la función de barrera del EPR, lo que resulta en una acumulación de LSR.
El daño secundario del EPR puede variar desde pequeñas lesiones focales hasta una degeneración extensa que a veces se denomina epiteliopatía pigmentaria retinal difusa o alteraciones atróficas difusas del EPR. Una teoría alternativa para explicar la patogénesis de la CCS postula que una pérdida focal de polaridad de las células del EPR induce el transporte activo de LSR al espacio subretinal.
g. Enfermedad paquicoroidea
La CCS se considera parte del espectro de la enfermedad paquicoroidea. Este espectro abarca varias enfermedades, todas ellas con características comunes que incluyen un aumento difuso o focal del grosor de la coroides, atrofia de las capas internas de la coroides, dilatación de las venas externas de la coroides —es decir “paquivasos”— e hiperpermeabilidad vascular coroidea en la AVI. Cabe señalar que el término paquicoroides significa literalmente “coroides engrosada”, por lo que es bastante inespecífico.
El progreso reciente en imágenes retinales con OCT con profundidad mejorada (EDI-OCT) y en OCT de barrido (swept-source-OCT) ha proporcionado nuevos conocimientos y permite el análisis estructural y funcional de la coroides. El incremento del grosor coroideo y la dilatación de los vasos coroideos evidenciados en la OCT y la hiperpermeabilidad coroidea evidenciada en la AVI apoyan el papel de la coroides como responsable en esta enfermedad. Hay evidencia adicional de vasculopatía coroidea en CCS gracias a los estudios con tinción que indican que en la fase media hay retardo en el llenado coroideo, sugiriendo isquemia coroidea con áreas asociadas de dilatación venosa35.
El hecho de que una coroides pueda o no considerarse engrosada está sujeto a debate y puede depender en gran medida de diversos factores, como el defecto de refracción, la longitud axial asociada y la hora del día. Muchos pacientes con una coroides relativamente engrosada nunca desarrollarán anomalías clínicamente relevantes como epiteliopatía pigmentaria paquicoroidea o CCS. Por el contrario, algunos pacientes desarrollan una CCS típica a pesar de tener un grosor coroideo dentro del rango normal. La mayoría de los pacientes con CCS, sin embargo, tienen un grosor coroideo significativamente aumentado en el ojo afectado.
En un estudio realizado por Warrow et al. se informó de una serie de pacientes con cambios en el EPR que se asemejaban a aquellos que se observaban en los casos de pacientes con CCS. Los autores establecieron que los cambios en el EPR están relacionados con un espectro de anormalidades coroideas encontradas típicamente en ojos con CCS36.
El término epiteliopatía pigmentaria paquicoroidea (EPP) se utiliza para describir esta entidad. Estos autores sugieren que los cambios vistos en el EPR en la EPP se pueden atribuir a focos de engrosamiento coroideo según OCT y a hiperpermeabilidad de la coriocapilaris en AVI. También demostraron que algunos cambios se desarrollan directamente sobre los vasos coroideos dilatados, debajo del complejo EPR/membrana de Bruch. Las imágenes de una cohorte de pacientes con enfermedad paquicoroidea reveló que el engrosamiento coroideo focal puede atribuirse a la dilatación patológica de las venas de la capa de Haller (paquivasos) y que en donde ocurren manifestaciones tisulares a nivel del EPR existe adelgazamiento paradójico de la coroides interna (coriocapilaris y capa de Sattler), dando por resultado la aproximación de paquivasos a la membrana de Bruch; de estos cambios surge la hipótesis de que la atenuación de la coriocapilaris puede producir un medio isquémico.
En otro estudio se analizaron ojos mediante OCT-A con enfermedad paquicoroidea que tenían zonas con reducción de la señal del flujo coroideo interno y vasos de la capa de Haller patológicamente dilatados; encontraron alta prevalencia de zonas de atenuación de la señal del flujo en ojos con enfermedad paquicoroidea que se correlaciona con paquivasos y concluyeron que la isquemia coroidea interna se podría relacionar con la patogénesis de la enfermedad paquicoroidea37.
La paquicoroides se asocia con la hipermetropía y la CCS es extremadamente rara en pacientes miopes; sin embargo, la CCS típica también puede ocurrir todavía en pacientes emétropes con un grosor coroideo dentro del rango “normal” pero disfuncional. Por lo tanto, una coroides engrosada (o relativamente engrosada) es un factor de riesgo y además las propiedades disfuncionales y “permeables” de esa coroides pueden ser al menos igual de importantes en la progresión de la enfermedad.
6. Diagnósticos diferenciales
El diagnóstico diferencial de la CCS abarca una amplia gama de categorías de enfermedades que deben tenerse en cuenta ante un desprendimiento neurorretinal seroso o un cuadro clínico sugestivo de tal desprendimiento. Las enfermedades más comunes en el diagnóstico diferencial incluyen enfermedades asociadas con la neovascularización macular, como la degeneración macular asociada a la edad (DMAE) y la vasculopatía coroidea polipoide. Para diferenciar entre estas enfermedades se deben obtener imágenes de OCT, angiografía OCT, AF y AVI. Las drusas retinales son una característica distintiva de la DMAE, mientras que las lesiones polipoides en la OCT, la angiografía OCT, la AF y especialmente la AVI son típicas de la vasculopatía coroidea polipoide. Otras enfermedades a tener en cuenta son las enfermedades oculares inflamatorias, hematológicas, genéticas, inducidas por medicamentos, los tumores oculares y las anomalías del desarrollo ocular.
7. Tratamientos
Hablar de un tratamiento óptimo es complicado debido a la amplia gama de presentaciones de la enfermedad y al curso clínico, así como a la fisiopatología poco conocida y a la falta de consenso sobre un sistema de clasificación. La mayoría de los estudios publicados hasta la fecha analizaron datos retrospectivos y variaron con respecto de sus criterios de inclusión y exclusión, definiciones clínicas y criterios de valoración del estudio.
Dado el abanico de intervenciones utilizadas para tratar la CCS (que se analiza en detalle más adelante) debería ser obvio que la elevada tasa de mejoría espontánea explicaría el hecho de que los ensayos no sistemáticos, no prospectivos y no aleatorios de una amplia gama de intervenciones hayan arrojado muchos resultados prometedores que nunca se han replicado satisfactoriamente.
a. Objetivos del tratamiento
El objetivo del tratamiento para la CCS es preservar las capas neurosensoriales externas de la retina y lograr la resolución completa del desprendimiento neuronal seroso y el LSR subyacente, ya que incluso una pequeña cantidad de LSR remanente puede provocar daños irreversibles en los fotorreceptores. Por lo tanto, se acepta comúnmente que la eliminación completa del LSR, con el fin de restaurar la interacción anatómica y funcional normal entre los fotorreceptores y el EPR, debe ser el principal criterio de valoración en los ensayos relativos a la CCS. Tras la restauración de la anatomía fotorreceptor-EPR, los síntomas visuales suelen disminuir gradualmente y la AVMC mejora. Incluso con un tratamiento anatómicamente exitoso, la persistencia de secuelas visuales debidas al daño retinal es relativamente común. Otro objetivo importante del tratamiento es prevenir las recurrencias y la posterior progresión de la enfermedad.
En la CCSa, que tiene una tasa relativamente alta de resolución espontánea, lo ideal sería que un tratamiento eficaz evite las recidivas y la posterior progresión de la enfermedad. En el CCSc, el objetivo principal del tratamiento es actualmente conseguir —y mantener— la resolución completa del LSR y del líquido intrarretinal (si está presente). Además, pueden tenerse en cuenta otros factores como los síntomas subjetivos, la edad del paciente y su dependencia profesional de una agudeza visual elevada.
b. Eliminación de los factores de riesgo
Independientemente del subtipo de CCS, es importante identificar si el uso de corticosteroides o la presencia de otros factores de riesgo están asociados. Así se puede aconsejar a los pacientes que interrumpan el uso de todas las formas de corticosteroides (incluida la medicación tópica e inhalada) siempre que su estado general de salud lo permita. En el caso de las mujeres en edad fértil que presenten CCS debe discutirse si la paciente está (o podría estar) embarazada. Se puede aconsejar la reducción del estrés emocional, el tratamiento de la ansiedad, una dieta sana y dormir lo suficiente, aunque no existen pruebas sólidas de efectos positivos con respecto de la CCS en este sentido.
c. Opciones de tratamiento
Fotocoagulación láser
Tradicionalmente el tratamiento de elección para la CCS ha sido con láser térmico de onda continua focal, normalmente con un láser de argón o diodo, pero también con un láser de criptón o xenón; donde el láser de diodo es superior al láser de argón en términos de resultados de la AVMC. Este método de tratamiento con láser se dirige al punto o puntos focales de fuga medidos en la AF e intenta cerrar el defecto focal en la barrera hematorretinal externa aplicando fotocoagulación a la zona afectada del EPR. La fotocoagulación con láser debe limitarse a los puntos de fuga extrafoveales, ya que en la zona tratada puede producirse pérdida de visión, escotoma, reducción de la sensibilidad al contraste y/o NVC. Aunque el tratamiento térmico con láser puede reducir la duración del LSR, la AV final no difiere significativamente en comparación con la ausencia de tratamiento. Se ha demostrado que el tratamiento de coagulación con láser reduce la prevalencia de recurrencia del LSR a 0 de 29 ojos tratados (en comparación con 7 de 16 ojos no tratados); además, el tratamiento aceleró el proceso de resolución completa a una media de 1 mes (en comparación con 19 meses para los ojos no tratados)38. Recientemente se sugirió la fotocoagulación láser navegada como una modalidad láser segura y eficaz para tratar la CCS. La fotocoagulación láser navegada integra la información obtenida mediante la fotografía del fondo de ojo y la AF para identificar la zona a tratar.
Aunque la fotocoagulación con láser navegada del punto de fuga focal en la AF logra la resolución completa del LSR entre el 75% y el 94% de los pacientes con CCSc, el resultado funcional con respecto de la AVMC es inconsistente. Un ensayo aleatorio prospectivo a largo plazo que comparó la fotocoagulación con láser de argón convencional con ningún tratamiento no encontró diferencias entre los dos grupos con respecto de la tasa de recurrencia o la agudeza visual. Los eventos adversos reportados con la fotocoagulación con láser incluyen NVC en el sitio de tratamiento (en 2 de 25 pacientes)23.
Láser de micropulso subumbral
El uso de un láser de diodo micropulso puede inducir efectos más sutiles en la retina externa en comparación con la fotocoagulación con láser. Es importante destacar que, a la dosis adecuada, el tratamiento con láser de micropulso puede dirigirse selectivamente al EPR preservando los fotorreceptores y sin causar daños visibles en el tejido. Se sugirió por primera vez como una opción para tratar el edema macular tras la oclusión venosa retinal y en pacientes con retinopatía diabética.
Sin embargo, no se conoce bien el mecanismo de acción subyacente al tratamiento con láser de micropulsos y no se han realizado grandes ensayos prospectivos controlados aleatorizados sobre el tratamiento con láser de micropulsos.
Con el láser de micropulso subumbral, la radiación fotónica se administra a la retina en pulsos de 0,1-0,5 s de duración. Este método permite disipar el calor entre los pulsos y minimiza los daños colaterales; así, la temperatura se mantiene por debajo del umbral de desnaturalización de las proteínas celulares y no se producen quemaduras por láser. Por lo tanto, la técnica láser subumbral no tiene efectos visibles en la retina. Con el tratamiento con láser de micropulso subumbral de alta densidad (HSML) para CCS los puntos láser se dirigen a las anomalías hiperfluorescentes en AVI y en algunos casos, AFA. La radiación es absorbida por los cromóforos del EPR —principalmente la melanina— y se disipa en forma de calor. Cuando se aplica en una dosis inferior a la letal se cree que el tratamiento aumenta la expresión de proteínas de choque térmico, lo que puede restaurar la función celular en el EPR39.
Hay varios parámetros ajustables del láser que incluyen las longitudes de onda, el ciclo de trabajo, la potencia, el tamaño del punto y la duración del pulso. Para complicar aún más el análisis muchas configuraciones varían entre los protocolos, incluida la longitud de onda del láser, lo que dificulta la comparación de los resultados de diferentes estudios de tratamiento y la determinación de la viabilidad del uso de HSML para CCS.
Terapia fotodinámica (TFD)
La terapia fotodinámica (TFD) con verteporfina se ha utilizado con eficacia para el tratamiento de la CCSc. Ahora bien, las ventajas del HSML sobre la TFD incluyen el hecho de que es un tratamiento más barato y que se evitan los potenciales eventos adversos asociados a TFD como reducción transitoria de la función macular, no perfusión coroidea, atrofia del EPR y NVC. Roca et al. realizaron un estudio comparativo retrospectivo multicéntrico de 159 ojos consecutivos con CCSc tratados con láser micropulsado o con TFD a media dosis de verteporfina39. A 12 meses de seguimiento, la AVMC mejoró en el grupo de micropulso, el 48,9% de ojos mejoró 3 o más líneas de visión, otro 48,9% de ojos permaneció dentro de 2 líneas, y el 2,2% de ojos perdió 3 o más líneas de AV. A los 12 meses de seguimiento en el grupo TFD, el 19% de ojos mejoró 3 o más líneas, el 73% permaneció dentro de 2 líneas y el 7% restante perdió 3 o más líneas de visión. No hubo eventos adversos atribuibles al tratamiento con láser micropulsado; mientras que un ojo en el grupo TFD desarrolló NVC que fue tratada con inyecciones de antiangiogénicos.
Aunque algunos pacientes con CCSa resuelven espontáneamente, la intervención oportuna con HSML puede acortar el curso de la enfermedad, mejorar la agudeza visual y reducir el riesgo de transformación crónica sin eventos adversos. Zeng et al. compararon la eficacia y seguridad de HSML vs TFD de media dosis en pacientes con CCSa estableciendo que la eficacia es similar entre ambas con menor riesgo de daño retinal por parte de HSML40. Hay varios estudios que respaldan estas afirmaciones, aunque es difícil establecer un consenso ya que la modalidad de tratamiento varía entre ellos. Se concluyó que tanto la TFD como el láser de micropulsos son efectivos en la restauración de la anatomía macular y que, en áreas donde la TFD no está disponible (como es nuestro medio), HSML es la alternativa adecuada de tratamiento.
La TFD consiste en la administración intravenosa de verteporfina, un agente fotosensibilizante que se acumula en los vasos sanguíneos coroideos, seguida de la aplicación selectiva de láser en las zonas que requieren de tratamiento, lo que provoca la excitación de las moléculas de verteporfina. En comparación con la fotocoagulación, los efectos inducidos por la TFD en el EPR son mucho menos destructivos.
El efecto terapéutico de la TFD en la CCS se basa probablemente en la formación de radicales libres al iluminar la zona de tratamiento —concretamente la coriocapilar—, lo que provoca daños en el endotelio vascular e hipoperfusión, así como la remodelación subsiguiente de los vasos del lecho capilar subyacente al EPR dañado. Debido a la alta selectividad del tratamiento (por alta afinidad de la verteporfina al EPR), los fotorreceptores retinales no se ven afectados.
Tras el tratamiento con TFD para la CCS unilateral, el grosor coroideo en el ojo tratado puede disminuir hasta el mismo valor de grosor coroideo que en el ojo no afectado. Este hallazgo sugiere que la TFD reduce la hiperpermeabilidad y el engrosamiento vascular coroideo que desempeñan un papel clave en la patogénesis de la CCS.
Sin embargo, hay que tener en cuenta que la TFD de media dosis con verteporfina es considerablemente más cara que otros tratamientos y requiere del uso de una máquina láser específica.
i) TFD en la CCS aguda
Un metaanálisis de 2016 de dos ensayos controlados aleatorizados y un estudio de cohortes controlado con placebo (113 ojos) comparó la CCSa tratada con media dosis de TFD frente a placebo. La TFD de media dosis demostró una mejora estadísticamente significativa en la AVMC a los 3 y 12 meses de seguimiento y en el grosor macular central a los 1, 3 y 12 meses de seguimiento en comparación con el placebo. A pesar de ello, el tratamiento de la CCS aguda con TFD todavía tiende a reservarse para pacientes con necesidades visuales elevadas dependientes del tiempo dado la alta tasa de resolución espontánea del líquido subretinal en estos pacientes41.
ii) TFD para la CCS crónica
El ensayo PLACE fue un ensayo abierto, multicéntrico, aleatorizado y controlado que comparó la TFD de media dosis guiada por AVI (3 mg/m2 BSA) con el láser de micropulso subumbral de alta densidad (HSML) guiado por AVI para el tratamiento del CCSc en 179 pacientes. Se los analizó en función de si presentaban fugas focales o difusas visibles en la AF. En el grupo de fugas focales, el grupo de TFD de media dosis presentó una resolución significativamente mayor del LSR. Del mismo modo, en el grupo de fuga difusa, el grupo de TFD de media dosis tuvo una resolución significativamente mayor del LSR. El grupo de media dosis de TFD mostró un mayor aumento de la agudeza visual42.
Los datos de este ensayo sugieren que la TFD de media dosis es un tratamiento eficaz para la CCSc, aunque puede ser ineficaz en algunos casos. En general, los autores del ensayo concluyeron que la TFD de media dosis es superior a la HSML en el tratamiento de la CCSc. De todas maneras, en la TFD no existe opción de retratar de manera indefinida a diferencia de HSML. Además no contemplan efectos adversos descritos en otros ensayos clínicos. Por lo tanto, asumir esta conclusión es al menos cuestionable.
iii) Seguridad de la TFD en la CCS
Para minimizar el riesgo de efectos secundarios se desarrolló la TFD de fraguado reducido para la CCS. En los numerosos estudios realizados hasta la fecha se han notificado efectos adversos graves —aunque en raras ocasiones— relacionados con el tratamiento, tales como NVC o atrofia del EPR. A pesar del perfil de seguridad globalmente favorable de la TFD en el tratamiento del CCS, la pérdida de visión en una categoría muy específica de CCSc grave como es aquella con atrofia extensa del EPR foveal, puede deberse a que la atrofia progresiva del EPR forme parte del curso natural de esta forma más grave. Sin embargo, esta minoría relativamente pequeña de pacientes debe ser asesorada sobre el riesgo de una mayor pérdida de visión tras la TFD.
A pesar de su eficacia demostrada, algunos estudios sugieren que el tratamiento con HSML presenta una eficacia similar y sin riesgos en el retratamiento. Además hay que tener en cuenta que la TFD es un terapia que en nuestro medio es de difícil acceso por su alto costo, complejidad del procedimiento y falta de disponibilidad de verteporfina. Es decir que el tratamiento de elección, ante estas dificultades, es la utilización de la HSML.
Termoterapia transpupilar
En el campo de la oftalmología, la termoterapia transpupilar (TTT) se describió por primera vez para tratar el melanoma coroideo. El objetivo de la TTT es inducir un ligero aumento de la temperatura específicamente en la zona a tratar (por ejemplo, a 45-60°C tras 1 min de tratamiento para el melanoma coroideo). Este aumento de temperatura puede activar una cascada de reacciones que presumiblemente implican la producción de proteínas de choque térmico que ayudan a reparar las células dañadas del EPR y también pueden provocar trombosis vascular coroidea. El mecanismo preciso por el que la TTT es eficaz en el tratamiento de la CCS no está claro, pero puede implicar la inducción de apoptosis en las células endoteliales y/o trombosis vascular, lo que puede ser útil para tratar las anomalías coroideas subyacentes en esta enfermedad.
En un estudio, el 79% de los pacientes con CCSc presentó una resolución completa del LSR tres meses después del tratamiento y el 53% de los ojos tratados tuvo una mejora de ≥3 líneas de agudeza visual. Manayath y sus colegas realizaron un TTT subumbral “graduado” en 10 ojos con CCSc utilizando inicialmente el 60% de la potencia umbral; si el LSR persistía al cabo de 1 mes, la potencia se aumentaba al 80% del umbral para una segunda sesión de tratamiento. Utilizando este protocolo, los autores descubrieron que 8 de los 10 ojos tratados (80%) tenían una resolución completa del LSR en la OCT y 5 (50%) de los ojos tenían una mejora de la AVC de ≥ 3 líneas. Luego estudiaron a 22 pacientes con CCSc que se negaron a someterse a TFD y por lo tanto se sometieron a TTT43. Los autores encontraron una reducción significativa en el grosor foveal medio pero ninguna diferencia significativa en la AV entre los pacientes que se sometieron a TTT y los pacientes que se sometieron a TFD; sin embargo, las personas que se habían sometido a TTT requirieron más sesiones de tratamiento y tuvieron un intervalo más largo hasta la resolución completa del LSR. Es decir que la TTT es una opción válida y comparable a la TFD aunque actualmente no es una opción de tratamiento utilizada por los oftalmólogos en nuestro medio. Por lo tanto, se justifican ensayos controlados aleatorios prospectivos adicionales para evaluar más a fondo la eficacia y la seguridad del uso de TTT para tratar el CSC.
Inyección intravítrea de antifactor de crecimiento endotelial vascular (VEGF)
Las pruebas experimentales sugieren que la inhibición del VEGF tiene un efecto antiproliferativo en las células endoteliales coroideas. Además, varios estudios clínicos con pacientes con DMAE y edema macular diabético han demostrado que la inhibición del VEGF contrarresta la fuga y la proliferación fibrovascular, disminuye el flujo sanguíneo coroideo y reduce el grosor coroideo central. Dado que se cree que la CCS se origina en la vasculatura coroidea, se han sugerido inyecciones intravítreas de compuestos anti-VEGF como bevacizumab, ranibizumab y aflibercept como posible tratamiento de la CCS mediante la modificación de la permeabilidad vascular coroidea44.
Aunque algunos estudios han investigado el uso de anti-VEGF para CCS, no se han realizado ensayos clínicos controlados, aleatorizados, prospectivos y de gran tamaño. Algunos estudios encontraron un efecto positivo. Por ejemplo, colegas descubrieron que el 80% de 15 pacientes tratados con bevacizumab presentaba una resolución completa del LSR en comparación con el 53% de 15 pacientes del grupo de control no tratados45. En un estudio prospectivo de 20 pacientes con CCSa que recibieron ranibizumab y 20 pacientes que no recibieron tratamiento, el LSR se resolvió en 4 semanas frente a 13 semanas, respectivamente46. Sin embargo, en un estudio prospectivo posterior con ranibizumab se informó de una resolución completa en solo el 13% de los ojos con CCSc tratados con ranibizumab después de 12 meses, en comparación con el 89% de los ojos tratados con TFD de baja fluencia. A pesar de estos informes positivos, aún no hay un metaanálisis que pueda confirmar los efectos positivos de bevacizumab, ranibizumab o aflibercept para CCSa. El tratamiento anti-VEGF puede ser mejor a la TFD en casos de pacientes con CCS y fibrina subretinal en la fóvea, siendo la TFD más propensa a complicaciones que las inyecciones intravítreas. Además se encontró buena respuesta en pacientes con CCS y NVC asociada.
Debido a la falta de grandes ensayos prospectivos y la explicación desconocida de su eficacia en la CCS, las inyecciones intravítreas de agentes anti-VEGF probablemente deberían limitarse a pacientes con CCS junto con NVC y/o vasculopatía coroidea polipoide.
Antagonistas de los receptores mineralocorticoides (MR) y de los receptores glucocorticoides
Los ojos con CCS presentan una coroides engrosada con paquivasos y se ha sugerido que se deba a la hiperpermeabilidad coroidea. Se evaluaron ratas con CCS donde la vasodilatación coroidea fue inducida por la aldosterona (un activador del receptor mineralocorticoide). La inhibición de esta vía impidió el engrosamiento coroideo inducido por la aldosterona, lo que sugiere que la activación del receptor mineralocorticoide podría contribuir a la patogénesis del CCS. Posteriormente, se han ensayado antagonistas orales de tal receptor como la eplerenona y la espironolactona en el CCS agudo y crónico con resultados desiguales.
En un metaanálisis de 2021 de cinco ensayos controlados aleatorizados y cuatro estudios de cohortes controlados con placebo (352 ojos) realizado por Duan et al. se comparó la AV y el líquido subretinal en pacientes con CCS (aguda o crónica) tratados con un antagonista de los receptores de mineralocorticoides (espironolactona o eplerenona) frente a placebo45. Este metaanálisis halló que el tratamiento con mineralocorticoides no proporcionó una diferencia estadísticamente significativa con respecto del placebo en la mejora de la AVMC en el seguimiento a 1, 3 y 6 meses. El análisis de subgrupos no mostró diferencias en los resultados de la AVMC entre la CCSa y la CCSc a los 1 o 3 meses de seguimiento. Sin embargo, la altura del LSR y el grosor coroideo subfoveal (GCFS) fueron significativamente inferiores en el grupo tratado con mineralocorticoides en comparación con placebo en el seguimiento de 1 mes y el GCFS también fue significativamente inferior en el seguimiento de 3 meses en el grupo tratado con mineralocorticoides. En general, este metaanálisis sugiere que el tratamiento con mineralocorticoides puede conducir a mejores resultados anatómicos a corto plazo; sin embargo, no tiene ningún efecto sobre la AV final en la CCS aguda o crónica.
Actualmente hay dos trabajos en curso: VICI y SPECTRA. En el primero, VICI es un ensayo clínico aleatorizado y controlado a doble ciego eplerenona vs placebo en pacientes con CCSc no tratada previamente durante un máximo de 12 meses46. El segundo, SPECTRA, es el primer ensayo que compara directamente la TFD y la eplerenona en la CCSc47. Ambos trabajos brindarán más herramientas a la hora de abordar el tratamiento de la CCSc con eplerenona. Aunque los ensayos clínicos realizados actualmente arrojaron conclusiones opuestas sobre el beneficio de la eplerenona, sigue siendo el mineralocorticoide con más apoyo para su uso en la CCSc. Los datos colectivos de los estudios realizados hasta la fecha sugieren que en la CCSa los antagonistas de los receptores mineralocorticoides pueden mejorar los resultados anatómicos, pero los datos sobre los resultados visuales son contradictorios. Se necesitan estudios de mayor tamaño para obtener una base de evidencia más sólida.
Otras drogas
Dentro del metaanálisis realizado por el Servicio de Oftalmología de la Universidad de Medicina Johns Hopkins en 2015 se describe —entre otros tratamientos— el uso de inhibidores de la anhidrasa carbónica como la acetazolamida para el tratamiento de la CCS, si bien su eficacia aún no ha sido establecida con certeza48. A su vez, analizan la terapia dirigida a la erradicación de la bacteria Helicobacter pylori ya que diversos estudios sugieren una posible asociación entre la infección y la CCS, presumiblemente debido a una respuesta inmune cruzada. Además, observaron un posible papel en la hipercoagulabilidad en la patogénesis de la CCS, lo que ha llevado a la consideración del uso de aspirina en algunos casos. También, se ha planteado la regulación del eje hipotalámico-hipofisario-adrenal, sugiriendo que los medicamentos que afectan este eje —como los antiglucocorticoides y los antidepresivos— podrían influir en la enfermedad48. Concluyeron que los estudios publicados de terapias alternativas carecen de respaldo de pruebas sólidas para evaluar si pueden beneficiar a los pacientes con CCS.
Por otro lado, se ha puesto en discusión como tratamiento antiinflamatorio ocular el uso de melatonina, ya que se reconoce su actividad antioxidante y su capacidad de reducción de los niveles de PGE2 y PGF2α en la retina, así como los niveles de COX-2 en el nervio óptico. Esta droga se está considerando para su uso en patologías oculares como uveítis y neuritis óptica, tanto de manera individual o combinada con corticosteroides, por lo que su uso se está investigando también para tratamiento de CCS49.
Tratamientos más usados actualmente para la CCS
La coriorretinopatía central serosa se suele dividir en dos categorías en función de la duración de los síntomas: la extensión de la fuga en la angiografía y la presencia de atrofia del EPR; estas dos categorías son la CCSa y la CCSc. La CCSc puede complicarse con NVC y/o degeneración retinal cistoide posterior (DRCP), que pueden considerarse complicaciones específicas de la CCSc. Según la bibliografía, la mayoría de los investigadores apoyan esta clasificación incompleta y relativamente rudimentaria. Sin embargo, actualmente no existe un consenso claro con respecto de los criterios de clasificación y se necesita un sistema de clasificación mejor definido. Su falta actual complica el estudio de la progresión natural de la enfermedad del CCS, su manejo terapéutico y el diseño de ensayos de intervención, que deben tener en cuenta la maculopatía de aparición relativamente temprana, la resolución espontánea común del LSR y el curso relativamente benigno de la enfermedad.
Tratamiento de la CCS aguda
Debido a la alta tasa de resolución espontánea del LSR en un plazo de tres a cuatro meses en la CCSa, la observación durante los primeros cuatro meses es la estrategia más utilizada, excepto en pacientes que requieren de una resolución rápida del LSR y de rehabilitación visual, por ejemplo por motivos profesionales o en casos con atrofia del segmento externo y/o restos granulares en el espacio subretinal. Aunque la CCSa suele resolverse espontáneamente, puede producir daño retinal en las fases iniciales y puede progresar mientras persista el desprendimiento neurorretinal seroso debido a la acumulación de LSR.
Los objetivos de una intervención en una CCS deben ser: reducir el tiempo necesario para restaurar la visión y estabilizar el pronóstico visual. En la práctica esto significa que debe resolverse el LSR y evitarse el desprendimiento neurorretinal seroso recurrente. Algunos tratamientos como la HSML y la TFD pueden disminuir el tiempo necesario para lograr la resolución completa del LSR.
La fotocoagulación de una fuga focal en la angiografía a veces puede conducir a la resolución rápida y completa del LSR; sin embargo, estos casos “ideales” —que tienen una fuente solitaria de fuga a una distancia relativamente segura de la fóvea— son infrecuentes y se dispone de pruebas limitadas con respecto de la eficacia y la seguridad a largo plazo. La fotocoagulación no aborda claramente la fuga coroidea subyacente y conlleva el riesgo de inducir una NVC o un escotoma paracentral sintomático.
En base a la evidencia actual, el consenso general es que el tratamiento relativamente temprano (dentro de los 4 meses de la presentación) con HSML puede considerarse en pacientes con CCSa activa que tuvieron episodios previos de LSR, pacientes con actividad bilateral de la enfermedad y/o pacientes que dependen de su visión por razones profesionales. En caso de LSR persistente, se puede considerar repetir HSML. La TFD podría ser el tratamiento de elección para la CCSa. Sin embargo, su difícil acceso y falta de evidencia que constate la superioridad sobre HSML hacen que hoy su uso esté relegado. De todas maneras se necesitan estudios aleatorios prospectivos de gran tamaño para establecer una base clara para un enfoque basado en la evidencia para tratar la CCSa.
Tratamiento de la CCS crónica
La persistencia del LSR en la CCSc se asocia a un daño fotorreceptor progresivo y parcialmente irreversible que conduce a la pérdida de agudeza visual y a una pérdida concomitante de la calidad de vida relacionada con la visión. Por lo tanto, el objetivo del tratamiento debe ser detener esta progresión y mejorar la visión. Los tratamientos más utilizados para la CCSc son la HSML, la TFD y la fotocoagulación con láser de argón.
Según los datos disponibles actualmente, la HSML y la TFD parecen ser las terapias más eficaces y seguras para la CCSc sin complicaciones adicionales. La TFD de media dosis o de media fluencia puede considerarse en pacientes sintomáticos con CCSc con LSR fuera de la fóvea, aunque el consenso hoy en día es la utilización de HSML, ya que varios estudios arrojaron una eficacia similar con menores efectos adversos que la TFD, además de la disponibilidad y menor complejidad del procedimiento. En el caso de que persista el LSR puede considerarse el retratamiento o iniciar la TFD (si está disponible).
La neovascularización subretinal macular puede ocurrir en pacientes con CCS, y se presenta con mayor frecuencia en pacientes con CCSc grave. Además, se informó que la NVC ocurre en el 2%-18% de los pacientes con CCSc. Aunque la NVC puede estar presente al inicio de un episodio de CCS, también puede desarrollarse gradualmente, particularmente en pacientes mayores de 50 años y/o con enfermedad prolongada23. La fuga subretinal de la neovascularización de tipo 1 (sub-EPR) debida a una neovasculopatía paquicoroidea puede simular una CCS no complicada. La NVC puede identificarse mediante técnicas de imagen multimodales como la OCT, la AF, la AVI y en particular, la OCT-A, aunque esta detección puede resultar complicada en el caso de NVC pequeñas en fase inicial y de CCS grave con anomalías coriorretinales extensas.
Por lo tanto, no es infrecuente que a un paciente se le diagnostique inicialmente una CCS sin NVC, aunque en realidad pueda haber una NVC pequeña en el momento del diagnóstico. El clínico debe sospechar la presencia de una NVC sobre todo en pacientes de edad relativamente avanzada en el momento de la aparición, que presentan una señal media/hiperreflectante por debajo de un desprendimiento irregular plano del EPR, una estructura presunta de NVC en la OCT-A y/o una “placa” de NVC bien delimitada (con o sin componente polipoide) en la AVI.
El tratamiento estándar para la CCS complicada con NVC subretinal activa es el tratamiento intravítreo con anti-VEGF posiblemente complementado con HSML o TFD de media dosis o media fluencia, ya que varios estudios han demostrado una buena eficacia en estos casos. Por ejemplo, el estudio MINERVA descubrió que el ranibizumab intravítreo es eficaz en la NVC debido a CCS. Los autores encontraron que los ojos con NVC debido a CCS tratados con ranibizumab tuvieron una mejora en la AVMC de 6,6 letras ETDRS, en comparación con solo 1,6 letras en el grupo simulado50. Un grupo interesante de pacientes con CCS vascularizada presenta DEP planos irregulares en los que se puede detectar una fina red neovascular en la OCT-A. Esta denominada “NVC silenciosa de tipo 1” puede ser en realidad bastante común en las CCS. Sin embargo, dado que la contribución de este tipo de NVC a la fuga subretinal así como su papel en la progresión de la pérdida de visión no se ha investigado, el uso de la terapia anti-VEGF en estos casos debe evaluarse cuidadosamente y puede aplazarse hasta que la fuga activa se haga evidente.
8. Casos poco claros
Algunos pacientes no encajan en los sistemas de clasificación comentados anteriormente. Por ejemplo, en algunos casos la presencia de NVC puede ser ambigua. En los momentos en los que el diagnóstico no está claro determinar el tratamiento óptimo puede ser un desafío. En tales casos, la estrategia de tratamiento puede depender de diversos factores como los deseos del paciente, la agudeza visual y la edad, así como también las preferencias personales del médico tratante.
La CCS es una enfermedad frecuente y compleja. Las teorías actuales sobre su patogenia hacen hincapié en la sobrecarga de la circulación venosa coroidea. En todos los pacientes debe hacerse énfasis en la modificación de los factores de riesgo, en particular el abandono de los corticosteroides. La OCT-A es preferible para detectar la CCS complicada por NVC, que responde al tratamiento intravítreo con anti-VEGF. La controversia sobre la clasificación de las CCS y los criterios de valoración clínicos deseados para el tratamiento siguen siendo temas importantes que deberán abordarse para optimizar el diseño de futuros ensayos controlados aleatorizados. El resultado de estos estudios facilitará sin duda el establecimiento de unas directrices de tratamiento de la CCS basadas en la evidencia.
Conclusiones
La HSML es la técnica más utilizada para el tratamiento del LSR no resolutivo secundario a CCS, pero la fotocoagulación con láser de argón y la TFD pueden ser útiles en determinadas situaciones. Es difícil establecer superioridad entre HSML y TFD ya que los estudios realizados presentan resultados variados, además de variables que hacen difícil su comparación. De todas maneras, el HSML es el método más utilizado y disponible en nuestro medio hoy en día.
Referencias
1. Gupta A, Tripathy K. Central serous chorioretinopathy. En: StatPearls [en línea]. Treasure Island (FL): StatPearls Publishing, 2023 Aug. Disponible en: https://www.ncbi.nlm.nih.gov/books/NBK558973/
2. Fung AT, Yang Y, Kam AW. Central serous chorioretinopathy: a review. Clin Exp Ophthalmol 2023; 51: 243-270.
3. Park JB, Kim K, Kang MS et al. Central serous chorioretinopathy: treatment. Taiwan J Ophthalmol 2022; 12: 394-408.
4. Ivanišević M, Stanić R, Ivanišević P, Vuković A. Albrecht von Graefe (1828-1870) and his contributions to the development of ophthalmology. Int Ophthalmol 2020; 40: 1029-1033.
5. Rosen E. Central serous retinopathy. Am J Ophthalmol 1948; 31: 734.
6. Bennett G. Central serous retinopathy. Br J Ophthalmol 1955; 39: 605-618.
7. Kitzmann AS, Pulido JS, Diehl NN et al. The incidence of central serous chorioretinopathy in Olmsted County, Minnesota, 1980-2002. Ophthalmology 2008; 115: 169-173.
8. Facello Olmedo FM, Ormaechea G. Coriorretinopatía serosa central aguda y crónica: cambios coroideos observados con tomografía de coherencia óptica con imagen de profundidad mejorada. Oftalmol Clin Exp 2021; 14: 71-80.
9. Daruich A, Matet A, Dirani A et al. Central serous chorioretinopathy: recent findings and new physiopathology hypothesis. Prog Retin Eye Res 2015; 48: 82-118.
10. Daruich A, Matet A, Marchionno L et al. Acute central serous chorioretinopathy: factors influencing episode duration. Retina 2017; 37: 1905-1915.
11. Ficker L, Vafidis G, While A, Leaver P. Long-term follow-up of a prospective trial of argon laser photocoagulation in the treatment of central serous retinopathy. Br J Ophthalmol 1988; 72: 829-834.
12. Gerendas BS, Kroisamer JS, Buehl W et al. Correlation between morphological characteristics in spectral-domain-optical coherence tomography, different functional tests and a patient's subjective handicap in acute central serous chorioretinopathy. Acta Ophthalmol 2018; 96: e776-e782.
13. Wang M, Munch IC, Hasler PW et al. Central serous chorioretinopathy. Acta Ophthalmol 2008; 86: 126-145.
14. Yannuzzi NA, Mrejen S, Capuano V et al. A central hyporeflective subretinal lucency correlates with a region of focal leakage on fluorescein angiography in eyes with central serous chorioretinopathy. Ophthalmic Surg Lasers Imaging Retina 2015; 46: 832-836.
15. Iida T, Yannuzzi LA, Spaide RF et al. Cystoid macular degeneration in chronic central serous chorioretinopathy. Retina 2003; 23: 1-7, quiz 137-138.
16. Cardillo Piccolino F, Lupidi M, Cagini C et al. Choroidal vascular reactivity in central serous chorioretinopathy. Invest Ophthalmol Vis Sci 2018; 59: 3897-3905.
17. Sahoo NK, Mishra SB, Iovino C et al. Optical coherence tomography angiography findings in cystoid macular degeneration associated with central serous chorioretinopathy. Br J Ophthalmol 2019; 103: 1615-1618.
18. Mrejen S, Balaratnasingam C, Kaden TR et al. Long-term visual outcomes and causes of vision loss in chronic central serous chorioretinopathy. Ophthalmology 2019; 126: 576-588.
19. Spaide RF, Klancnik JM Jr. Fundus autofluorescence and central serous chorioretinopathy. Ophthalmology 2005; 112: 825-833.
20. Conrad R, Geiser F, Kleiman A et al. Temperament and character personality profile and illness-related stress in central serous chorioretinopathy. ScientificWorldJournal 2014; 2014: 631687.
21. Miki A, Kondo N, Yanagisawa S et al. Common variants in the complement factor H gene confer genetic susceptibility to central serous chorioretinopathy. Ophthalmology 2014; 121: 1067-1072.
22. Negi A, Marmor M.F. Experimental serous retinal detachment and focal pigment epithelial damage. Arch Ophthalmol 1984; 102: 445-449.
23. Nicholson B, Noble J, Forooghian F, Meyerle C. Central serous chorioretinopathy: update on pathophysiology and treatment. Surv Ophthalmol 2013; 58: 103-126.
24. Spaide RF. Choroidal blood flow: review and potential explanation for the choroidal venous anatomy including the vortex vein system. Retina 2020; 40: 1851-1864.
25. Pang CE, Shah VP, Sarraf D, Freund KB. Ultra-widefield imaging with autofluorescence and indocyanine green angiography in central serous chorioretinopathy. Am J Ophthalmol 2014; 158: 362.e2-371.e2.
26. Brinks J, van Dijk EHC, Meijer OC et al. Choroidal arteriovenous anastomoses: a hypothesis for the pathogenesis of central serous chorioretinopathy and other pachychoroid disease spectrum abnormalities. Acta Ophthalmol 2022; 100: 946-959.
27. Imanaga N, Terao N, Nakamine S et al. Scleral thickness in central serous chorioretinopathy. Ophthalmol Retina 2021; 5: 285-291.
28. Fernández-Vigo JI, Moreno-Morillo FJ, Shi H et al. Assessment of the anterior scleral thickness in central serous chorioretinopathy patients by optical coherence tomography. Jpn J Ophthalmol 2021; 65: 769-776.
29. Sirakaya E, Duru Z, Kuçuk B, Duru N. Monocyte to high-density lipoprotein and neutrophil-to-lymphocyte ratios in patients with acute central serous chorioretinopathy. Indian J Ophthalmol 2020; 68: 854-858.
30. Zola M, Gobeaux C, Javorsky T et al. Galectin 3 and central serous chorioretinopathy: a promising new biomarker. Proc ARVO Annual Meeting 2021; 2021: 2197.
31. Bahadorani S, Maclean K, Wannamaker K et al. Treatment of central serous chorioretinopathy with topical NSAIDs. Clin Ophthalmol 2019; 13: 1543-1548.
32. Lehmann M, Bousquet E, Beydoun T, Behar-Cohen F. Pachychoroid: an inherited condition? Retina 2015; 35: 10-16.
33. Schubert C, Pryds A, Zeng S et al. Cadherin 5 is regulated by corticosteroids and associated with central serous chorioretinopathy. Hum Mutat 2014; 35: 859-867.
34. Zhang X, Lim CZF, Chhablani J, Wong YM. Central serous chorioretinopathy: updates in the pathogenesis, diagnosis and therapeutic strategies. Eye Vis (Lond) 2023; 10: 33.
35. Potsaid B, Baumann B, Huang D et al. Ultrahigh speed 1050 nm swept source/fourier domain OCT retinal and anterior segment imaging at 100,000 to 400,000 axial scans per second. Opt Express 2010; 18: 20029-20048.
36. Warrow DJ, Hoang QV, Freund KB. Pachychoroid pigment epitheliopathy. Retina 2013; 33: 1659-1672.
37. Gal-Or O, Dansingani KK, Sebrow D et al. Inner choroidal flow signal attenuation in pachychoroid disease: optical coherence tomography angiography. Retina 2018; 38: 1984-1992.
38. Burumcek E, Mudun A, Karacorlu S, Arslan MO. Laser photocoagulation for persistent central serous retinopathy: results of long-term follow-up. Ophthalmology 1997; 104: 616-622.
39. Roca JA, Wu L, Fromow-Guerra J et al. Yellow (577 nm) micropulse laser versus half-dose verteporfin photodynamic therapy in eyes with chronic central serous chorioretinopathy: results of the Pan-American Collaborative Retina Study (PACORES) Group. Br J Ophthalmol 2018; 102: 1696-1700.
40. Zeng M, Chen X, Song Y, Cai C. Subthreshold micropulse laser photocoagulation versus half-dose photodynamic therapy for acute central serous chorioretinopathy. BMC Ophthalmol 2022; 22: 110.
41. Yannuzzi LA, Slakter JS, Gross NE et al. Indocyanine green angiography-guided photodynamic therapy for treatment of chronic central serous chorioretinopathy: a pilot study. Retina 2003; 23: 288-298.
42. van Dijk EHC, Fauser S, Breukink MB et al. Half-dose photodynamic therapy versus high-density subthreshold micropulse laser treatment in patients with chronic central serous chorioretinopathy: the place trial. Ophthalmology 2018; 125: 1547-1555.
43. Manayath GJ, Narendran V, Arora S et al. Graded subthreshold transpupillary thermotherapy for chronic central serous chorioretinopathy. Ophthalmic Surg Lasers Imaging 2012; 43: 284-290.
44. Peiretti E, Caminiti G, Serra R et al. Anti-vascular endothelial growth factor therapy versus photodynamic therapy in the treatment of choroidal neovascularization secondary to central serous chorioretinopathy. Retina 2018; 38: 1526-1532.
45. Duan J, Zhang Y, Zhang M. Efficacy and safety of the mineralocorticoid receptor antagonist treatment for central serous chorioretinopathy: a systematic review and meta-analysis. Eye (Lond) 2021; 35: 1102-1110.
46. Daugirdas SP, Bheemidi AR, Singh RP. Should we stop treating patients with eplerenone for chronic CSCR?: commentary on the VICI trial. Ophthalmic Surg Lasers Imaging Retina 2021; 52: 308-310.
47. Feenstra HMA, van Dijk EHC, van Rijssen TJ et al. Long-term follow-up of chronic central serous chorioretinopathy patients after primary treatment of oral eplerenone or half-dose photodynamic therapy and crossover treatment: SPECTRA trial report No. 3. Graefes Arch Clin Exp Ophthalmol 2023; 261: 659-668.
48. Salehi M, Wenick AS, Law HA et al. Interventions for central serous chorioretinopathy: a network meta-analysis. Cochrane Database Syst Rev 2015; 2015: CD011841.
49. Gramajo AL, Marquez GE, Torres VE et al. Therapeutic benefit of melatonin in refractory central serous chorioretinopathy. Eye (Lond) 2015; 29: 1036-1045.
50. Lai TYY, Staurenghi G, Minerva Study Group et al. Efficacy and safety of ranibizumab for the treatment of choroidal neovascularization due to uncommon cause: twelve-month results of the Minerva Study. Retina 2018; 38: 1464-1477.