
Figura 1. Esquema del plexo sub-basal normal y su alteración ante diferentes situaciones (ojo derecho).
ARTÍCULO DE REVISIÓN
Génesis del queratocono, el “neuromisterio” mejor guardado: una visión neuroquímica y neurodegenerativa
Roberto Albertazzia y Tomás Blancob
aCentro de Ojos Quilmes, Argentina. World Keratoconus Society & Keratoconus Forum.
bSchepens Eye Research Institute, Ophthalmology Department, Harvard Medical School, Estados Unidos.
Recibido: 21 de junio de 2020.
Aceptado: 2 de noviembre de 2020.
Dr. Roberto Albertazzi
albertazzirg@gmail.com
Oftalmol Clin Exp (ISSN 1851-2658)
2020; 13(4): 173-188.
RESUMEN
El roce vigoroso del globo ocular puede ser uno de los factores desencadenantes más frecuentes —pero no siempre determinante— en la génesis de las ectasias corneales. Sin embargo, para entenderlo, se debe considerar primero que la córnea es la estructura más densamente inervada del organismo, donde las células se alinean al tejido nervioso amielinizado en una trama guiada por corrientes magneto-táxicas, con dos sistemas de conducción diferentes: el sencillo arco reflejo —donde el estímulo genera una respuesta eferente— y el arco, donde el estímulo produce una inflamación previa a su respuesta. Esto es similar a lo que sucede en los bronquios, pulmones e intestinos, donde la inflamación media en la dirección del estímulo eferente, lo cual podría ser el estímulo inicial del proceso que genera finalmente el roce ocular, en modo similar a la forma como se produce la tos o el aumento de la velocidad del tránsito intestinal.
Cuando los estadios de las ectasias progresan es claro observar desorganización, ruptura del plexo sub-basal y metabolitos producto de la neurodegeneración. Para mejorar el diagnóstico y el tratamiento futuro será necesario identificar quién lidera estos cambios que afectan y se expresan con las alteraciones estructurales del colágeno de la córnea.
Palabras clave: queratocono, fisiología, fisiopatología; neurodegeneración, inervación corneal.
The genesis of keratoconus, a well kept “neuro-mystery”: a neurochemical and neurodegenerative point of view
ABSTRACT
The act of rubbing eyes with hardness is believed to be one of the most frequent predisposing factors, but not the determinant, in the genesis of the corneal ectasia. However, to better understand this phenomenon, we should consider the cornea is the most densely innervated structure of the body, with cells aligned to unmyelinated nerve fibers that are guided by magneto-taxis waves with two different conduction directions: the arc reflex, where the stimulus generates an efferent response, and the arc where the stimulus generates an inflammatory process previous to their response. This is similar to what happens in the respiratory system or the gut where the inflammation is organized in the direction of the efferent stimuli. These initial stimuli, from the processes which finally are generating the act of rubbing eyes, are similar as it happens with the cough reflex or the bowel movements.
When the corneal ectasia stages are progressing, clearly is possible to observe disorganization and rupture of the sub-basal nervous plexus, as well as changes in metabolites, secondary to the neurodegenerative process. To improve diagnosis and futures treatments, it is mandatory to identify what is leading those changes, which are expressing and affecting structural alterations of the corneal collagen.
Keyword: keratoconus, physiology, physiopathology, neurodegeneration, corneal innervation.
Gênese do ceratocone, a “neuromia” melhor guardada: uma visão neuroquímica e neurodegenerativa
RESUMO
O esfregar vigoroso do globo ocular pode ser um dos gatilhos mais frequentes —mas nem sempre decisivo— na gênese das ectasias corneanas. Porém, para entendê-lo, deve-se primeiro considerar que a córnea é a estrutura mais densamente inervada do corpo, onde as células são alinhadas ao tecido nervoso amielínico em uma trama guiada por correntes magneto-táxicas, com dois sistemas de condução distintos: o simples arco reflexo —onde o estímulo gera uma resposta eferente— e o arco, onde o estímulo produz inflamação antes de sua resposta. Isso é semelhante ao que acontece nos brônquios, pulmões e intestinos, onde a inflamação medeia na direção do estímulo eferente, que poderia ser o estímulo inicial do processo que finalmente gera a fricção ocular, de forma semelhante ao que é produzida a tosse ou o aumento da velocidade do trânsito intestinal.
Quando os estágios da ectasia progridem, é evidente a desorganização, ruptura do plexo sub-basal e metabólitos produto da neurodegeneração. Para melhorar o diagnóstico e o tratamento futuro, será necessário identificar quem lidera essas alterações que afetam e se expressam com as alterações estruturais do colágeno da córnea.
Palavras chave: ceratocone, fisiologia, fisiopatologia; neurodegeneração, inervação da córnea.
INTRODUCCIÓN
Esta revisión busca aportar un enfoque diferente a los orígenes del queratocono: pretende comprender su fisiopatología tras analizar datos científicos, aspectos de la medicina basada en la evidencia y centrarse en los cambios derivados del daño de la red nerviosa de la córnea.
Pero vamos a iniciar de una forma diferente. Hagamos una analogía “entre nosotros” acerca de las incógnitas del funcionamiento básico de la biología, proponiendo razonamientos similares a un enigma policial:
¿Hay una víctima?
Sí, efectivamente. Se trata de la deformación progresiva de la córnea con la pérdida de sus cualidades biomecánicas y ópticas, que posteriormente pueden afectar su transparencia y, en casos más severos, llegar a su perforación.
¿Quiénes son los sospechosos de estos daños?
En un estudio previo en el cual se evaluaron diferentes variables, se observó que el roce vigoroso del globo ocular es el factor más frecuentemente asociado, si bien no es la causa última determinante1.
¿Cuál es el motivo de este roce?
Los trabajos específicos lo señalan como un hábito —por ejemplo al levantarse—, una respuesta a la fatiga ocular, una respuesta relacionada con el estrés emocional2; pero todo indica un componente secundario a síntomas molestos como sequedad y picazón, o psicogénico con comportamiento compulsivo no provocado3-7. Probablemente este comportamiento compulsivo sea causado por el estrés mental o la tensión emocional y la psicogénesis podría estar asociada con el frotamiento anormal de los ojos8 o, lo que es más probable, ser un componente de ambos. En un estudio previo en el cual se incluyó una encuesta a 240 pacientes con queratocono, se encontró que el 65,6% tenía el hábito de frotarse los ojos9. Esto fue además confirmado en otro estudio por McGhee y colaboradores quienes encontraron que el 48% de los pacientes con queratocono tenía ese mismo hábito10. Similares resultados encontraron AlShammari y colaboradores, quienes observaron que el 44,8% de los pacientes también rutinariamente se frotaba los ojos11.
¿Y las atopías?
Un estudio reciente muestra una asociación entre el queratocono y la atopía, así como el roce ocular y los antecedentes familiares del paciente con queratocono. Sin embargo, y de forma muy llamativa, tras un posterior análisis estadístico multivariado, se encontró que sólo el factor del frotado ocular se mostraba como el único elemento significativo y susceptible de predecir el desarrollo del queratocono1.
El componente genético, ¿no será genética?
Es probable que la etiología sea multifactorial con una vía común para una variedad de procesos patológicos diferentes12-14. Varios estudios sugieren el componente genético como uno de los factores etiológicos fundamentales, pero aún se desconoce su proporción en pacientes15-18. Esto lo sugiere la incidencia familiar y su discordancia en la aparición entre gemelos monocigóticos y dicigóticos19-20; aun así, se trata de un componente de fundamental importancia para el seguimiento futuro.
Entonces, ¿es inflamatoria?
Más adelante trataremos las alteraciones enzimáticas y los mediadores estructurales, procurando precisar cuáles son las enzimas o sustancias que generan los primeros cambios para poder contestar esta pregunta.
El roce vigoroso, ¿es entonces el causante?
Si bien existe cierta discordancia en este punto, ya que, por un lado, hay trabajos que afirman que el frotado ocular no es necesario para su aparición21-22, por el otro, se entiende que en los pacientes con queratocono el frotado siempre se interpretó como su principal factor predictivo atendiendo a estudios multivariables1. Además, a nivel clínico también se observó que el queratocono está más desarrollado en el lado de la mano dominante3, si bien se desconoce el origen de ese frotado, asumiendo que su génesis corresponde a una acción voluntaria. Ahora bien, ¿es tan voluntaria como se cree? Nuevamente nos confronta a la paradoja presente en la frase de quién fue primero, ¿el huevo o la gallina?
Por lo general, en una novela policial nadie es el culpable hasta que nos damos cuenta de que el responsable ha estado allí desde el principio, lo que nos lleva a darle otro marco a este comienzo. Esta analogía sobre el misterio policial, sospecha y pruebas, es en realidad la forma de razonamiento que debemos mantener siguiendo el método científico. Observamos hechos, razonamos, pre-formamos una o varias ideas y en esta/s premisa/s formulamos nuestra hipótesis sobre los hechos acontecidos. Posteriormente, analizamos variables, parámetros (pruebas) para poder generar resultados que nos guíen a corroborar o refutar nuestra/s hipótesis o lo que en realidad es: el método científico. Esto es de gran relevancia ya que a día de hoy el queratocono sigue siendo uno de los misterios para la oftalmología y por tanto su estudio es fundamental —y por su alta incidencia en la población— está sobradamente justificado.
Bases neuroquímicas:conceptos generales y aplicados a la córnea
Hormonas y sustancias neuroquímicas
Si bien el cerebro es el encargado de generar nuestras respuestas, es en realidad el sistema nervioso en su conjunto el responsable de recibir toda información que, junto con el sistema endocrino, generan todas las respuestas según sus necesidades. Todo lo logra gracias a los mediadores químicos o sustancias mensajeras: el sistema nervioso generará los neurotransmisores y el sistema endocrino producirá las hormonas, a excepción de la hipófisis, que dentro del sistema nervioso central gesta hormonas.
¿En qué se diferencian estos dos tipos de sustancias mensajeras? Las hormonas son liberadas al torrente sanguíneo, distancia variable de sus órganos diana, mientras que los neurotransmisores son liberados dentro del espacio sináptico, que es una zona de intercambio entre la neurona emisora (menos de una micra) y las células, grupos de células o axones efectores de la señal. Además las hormonas tienen un efecto largo e impreciso con larga duración comparado al efecto de los neurotransmisores, que será preciso y de muy corta duración.
El sistema nervioso periférico, con su profusa inervación, es responsable en gran parte del control corneal. Cabe recordar que esta inervación proviene del trigémino a través de su rama oftálmica que pasa por el ganglio ciliar y los nervios ciliares forman el plexo perilimbar desde donde penetran en la córnea desprovistos de la mielina23. Estos troncos axonales mantienen un flujo axoplásmico bidireccional y pueden cambiar de dirección y grosor. Una vez en el estroma corneal ascienden hacia las células epiteliales formando el plexo sub-basal, finalizando en una profusa terminación intraepitelial perpendicular al plexo que puede llegar a ser 7.000 terminaciones nerviosas por mm2 que le confieren una sensibilidad 100 veces mayor que la conjuntiva5-6, de 300 a 600 veces más que la piel; siendo incluso mucho más sensible que la pulpa dental23-24.
Anatomía del plexo sub-basal
La mayoría de los nervios de la córnea derivan de la división oftálmica del nervio trigémino (nervios sensitivos), inervándola a través de los nervios ciliares anteriores. Como dato histórico, en 1895 se publicó un trabajo que aportaba datos para confirmar la importancia del trigémino y su influencia trófica sobre la córnea25. Se sabe que la córnea también recibe inervación simpática del ganglio cervical superior y parasimpática del ganglio ciliar, si bien esta última no está bien descrita23. Los nervios penetran en la córnea en el tercio medio del estroma donde pierden su vaina de mielina y dirigiéndose hacia adelante en sentido anterior de forma radial y centrípeta (hacia el centro) a una distancia de aproximadamente 1 mm del limbo corneal, dando lugar a ramas que inervan las capas estromales anterior y media23-24.
En la interfaz existente entre la capa de Bowman y el estroma anterior, los nervios forman el plexo nervioso subepitelial26-27. Desde allí pasan a través de la capa de Bowman y forman el plexo nervioso sub-basal, que proporciona inervación a la capa de células epiteliales basales. Desde este plexo se emiten prolongaciones intraepiteliales hacia las capas celulares del epitelio superficial. Todos los nervios penetran la córnea radialmente en haces formados por 70 a 80 troncos nerviosos donde cada uno contiene de 900 a 1200 axones que penetran en el estroma medio. Los haces de nervios mielinizados pierden sus vainas de mielina 1 mm antes del limbo y el perineuro después de entrar en el estroma23, 27. Todas las ramificaciones nerviosas pierden su vaina mielínica, conformada por células de Schwann, antes de inervar la córnea con la finalidad de mantener la transparencia. En la figura 1A se observa la diferencia de densidad, cantidad y tipo de recorridos de las terminaciones nerviosas centrales y las periféricas.
Hay un flujo eléctrico anteroposterior del globo ocular de 6 microvoltios28 que genera fuerzas electromagnéticas en sentido centrípeto, y la migración de células estaría dado por esta diferencia de voltaje anteroposterior (fig. 2)29. Debido a que los nervios sub-basales dan lugar a ramas nerviosas intraepiteliales, que son perpendiculares al plano sub-basal, durante el movimiento centrípeto del epitelio corneal tanto el intra-epitelial, nervios y células epiteliales deben avanzar en la misma dirección y velocidad. Esto también explicaría la configuración en espiral de los nervios sub-basales30 (fig. 1A), aunque no debemos olvidar que una característica principal de la disposición anatómica está dada para garantizar el privilegio inmunológico del eje visual.

Figura 1. Esquema del plexo sub-basal normal y su alteración ante diferentes situaciones (ojo derecho).

Figura 2. Esquema de la migración de células por diferencias en el voltaje ántero-posterior.
Inervación corneal
Para que el sistema funcione correctamente necesitaremos de las vías receptoras (eferentes) compuestas por terminaciones nerviosas sensitivas, que se pueden clasificar en:
Los receptores (aferentes) responsables de originar una respuesta ante el estímulo recibido participarán en:
Es muy importante resaltar lo que varios estudios han demostrado: que las neuronas sensoriales influyen directamente en la integridad del epitelio corneal23-25, 31-34. Ante la presencia de destrucción neuronal o de interrupción en el flujo axonal, las células epiteliales se hipertrofian, pierden microvellosidades y producen una lámina basal anormal. Esto puede demorar o detener la mitosis en la parte germinal basal y pérdidas de adhesión, lo que conduce definitivamente a la ruptura del epitelio. Recordaremos aquí que la ablación del ganglio ciliar origina la aparición de úlceras neurotróficas por el cese y la derivación del flujo bidireccional axonal y su correspondiente pérdida neurotrófica23, 30.
Los nervios simpáticos corneales regulan los procesos de transporte de iones epiteliales, ejercen influencias inhibidoras sobre la mitosis epitelial y durante la cicatrización de heridas, y también pueden modular la sensibilidad corneal31, 34.
Los nervios parasimpáticos que se proyectan desde el ganglio ciliar envían algunos axones hacia la porción anterior del ojo para inervar el músculo ciliar, el músculo esfínter del iris y la córnea23. De todos los neurotransmisores y sustancias tróficas secretadas, la acetilcolina es la más importante porque favorece el incremento de la actividad mitótica epitelial35-36.
La córnea así se transforma en el órgano con mayor sensibilidad en contacto con el medio externo y esta sensibilidad resulta fundamental como integrante del ciclo reflejo de la secreción lagrimal, del parpadeo y para mantener un correcto trofismo celular.
Reflejo axonal, inflamación neurogénica y neurodegeneración corneal
Un arco reflejo clásico implica un receptor sensorial en el punto de contacto de la terminal nerviosa con un estímulo excitante (el punto de partida), un efector terminal en el destino (el punto final) y un centro de integración que se conectan mediante una sinapsis (transmisión ortodrómica)30.
A diferencia del reflejo clásico, el reflejo axonal no pasa por una sinapsis. El estímulo propaga un impulso que viaja centralmente a lo largo del nervio hasta el punto de bifurcación desde donde invierte la dirección y se transmite por la rama nerviosa hasta un órgano terminal (transmisión antidrómica) como un vaso sanguíneo o una glándula37.
La triple respuesta de Lewis implica la aparición de una línea roja a los pocos segundos de la lesión de la piel con un objeto puntiagudo que representa una dilatación capilar inmediata en respuesta a la liberación de histamina; seguido en unos minutos con enrojecimiento o brote circundante debido a la dilatación arteriolar neurogénica, que es seguida por un habón blanco como resultado de la exudación de plasma de los capilares38.
La fisiopatología involucra una secuencia de eventos que comienza con la estimulación de nociceptores polimodales por un estímulo que genera impulsos que se transmiten tanto al sistema nervioso central de forma ortodrómica como a la piel vecina o conjuntiva (limbo) de forma antidrómica.
La estimulación antidrómica induce la liberación de neuropéptidos, principalmente calcitonin gen-related peptide (CGRP, por sus siglas en inglés) y substance P (SP, por su sigla del inglés), que actúan directamente sobre el endotelio vascular y el músculo liso39. El CGRP induce la vasodilatación uniéndose a los receptores en las paredes arteriolares produciendo la respuesta de llamarada, y SP se une a los receptores en los mastocitos induciendo la liberación de histamina40, lo que aumenta la permeabilidad capilar provocando la respuesta del enrojecimiento. Cuando se mantiene el estímulo, los neuropéptidos pueden mediar en la inflamación neurogénica a través de la atracción y posterior activación de las células inmunes innatas (mastocitos, células presentadoras de antígeno profesionales como células dendríticas o macrófagos) y adaptativas (células T)41-42.
La inflamación neurogénica es un término utilizado para describir la inflamación mediada por neuropéptidos y neuromediadores liberados de las fibras aferentes de los nervios sensoriales y también de los nervios autónomos, principalmente simpáticos posganglionares. Las sustancias clave son taquicininas, CGRP y citoquinas proinflamatorias, especialmente IL643. Estos mediadores actúan directamente sobre los vasos sanguíneos adyacentes para promover la vasodilatación y extravasación de células inflamatorias al tejido corneal. Se conoce perfectamente que en enfermedades autoinmunes este mecanismo produce inflamación en otros tejidos como las articulaciones, el colon, los pulmones y la vejiga.
Alteraciones anatómicas del plexo sub-basal (PSB) por envejecimiento
Es evidente la disminución progresiva con la edad del número de ramificaciones nerviosas, densidad y del número de terminales nociceptivas (estructuras puntiformes adyacentes o sobre los haces nerviosos) (fig. 1B). Esta involución puede obedecer a una caída en el aporte neurotrófico, que a su vez sería la base etiológica de la disminución en la secreción lagrimal con el envejecimiento44-45.
Mediante imágenes de microscopía confocal Gambato y colaboradores describieron un mosaico del aspecto normal a diferentes profundidades comenzando desde el epitelio44. En la figura 3 se representa un esquema simplificado que demuestra o pone en evidencia la diferente composición de la parte externa corneal con la interna.
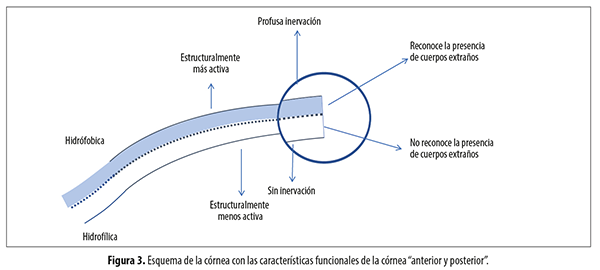
Figura 3. Esquema de la córnea con las características funcionales de la córnea “anterior y posterior”.
Nervios y queratocono
Alteraciones anatómicas de la inervación corneal en condiciones de “estrés mecánico”
El uso a largo plazo de lentes de contacto que se adaptan a la curvatura de la córnea se ha asociado con una reducción considerable en la sensibilidad corneal y de la misma manera su desuso se asocia con una recuperación total de la sensibilidad corneal46. Sin embargo, con el uso de lentes de contacto permeables al gas (ortoqueratología) esta reducción de la sensibilidad corneal no se observa de forma tan drástica47. Estos tipos de lentes tienen un diseño inverso, es decir, aplanan o ejercen presión positiva en la zona central de la córnea (dejando siempre un delgado film precorneal) y ejercen presión negativa en la periferia con zonas intermedias de presión neutra. El paciente utiliza este tipo de lentes solo cuando está durmiendo. Esto fue contrastado en un estudio reciente donde se observó con microscopía confocal que el plexo sub-basal de los usuarios de lentes Orto-K presentaba alteraciones (ver a continuación) en su distribución comparado con personas no usuarias de lentes de contacto (fig. 1C)48.
Desde el punto de vista neurológico, la aparición de estas alteraciones es previsible, ya que toda actividad compresiva (presión positiva) sobre un axón puede causar diferentes alteraciones como las que se describen a continuación:
Podemos apreciar que el plexo sub-basal muestra mayores signos de adelgazamiento axonal en la córnea central (zona donde se ejerce mayor presión) que en la periférica (zona donde se ejerce menor presión) si comparamos y analizamos detalladamente las figura 1C.
La reducción en la densidad de las fibras nerviosas centrales se ubica en el área de aplanamiento corneal48. Esto sugiere que la fuerza compresiva ejercida por la lente Orto-K, sumada a la fuerza ejercida por el párpado sobre la superficie de la córnea, pudiese ser la causante de la reducción en la densidad nerviosa observada en el plexo sub-basal central. En otro sentido, el evidente aumento en la densidad y en el grosor de las fibras nerviosas de la mediana periferia se produce en una zona en la que no existe cambio alguno en el perfil corneal inducido por la presión de la lente (zona de presión neutra o negativa). La causa del engrosamiento de los troncos nerviosos en la media periferia corneal se podría atribuir a una respuesta típica de cualquier red nerviosa periférica del cuerpo humano sometida a compresión. Son los somas neuronales ubicados en el ganglio del trigémino, que por medio de quimiotaxis redirigen las neuritas reforzadas estructuralmente (es decir, sus axones más gruesos) hacia regiones celulares de la córnea con poca o ninguna resistencia causada por la compresión49. Esto permite un mejor sistema de transporte de neurotransmisores y sustancias neurotróficas que favorecen la homeostasis del estroma anterior y el epitelio corneal.
Alteraciones de la inervación en el queratocono
Los nervios sensoriales protegen la córnea de las amenazas y de estímulos externos nocivos mediante el inicio de mecanismos nerviosos reflejos. Además de sus importantes funciones sensoriales, los nervios corneales ayudan a mantener la integridad funcional de la superficie ocular por la liberación de sustancias tróficas (neuropéptidos, neurotrofinas y factores de crecimiento) que promueven la homeostasis del epitelio corneal y la activación de los circuitos neurales del tronco cerebral que estimulan los ciclos reflejos de producción de lágrimas y del parpadeo23-24, 31, 34. En consecuencia, si existe daño a los nervios de la córnea como resultado de una cirugía, trauma, patología o infección, conlleva a la disminución de la sensibilidad corneal y a posibles alteraciones transitorias o de largo plazo en la integridad funcional de la superficie ocular31, 50.
Se han descrito diferentes cambios anatómicos de los nervios corneales en pacientes con queratocono. A nivel clínico se describen como nervios prominentes que también se encuentran asociados a otras patologías como neoplasia endocrina múltiple, lepra o neurofibromatosis51. A nivel histológico y con tomografía de coherencia óptica se han descrito cambios en el plexo sub-basal como incremento de la tortuosidad, disminución del número de fibras y reducción de la densidad de las ramificaciones (fig. 1D)52-53.
En varios estudios realizados con microscopía confocal in vivo en pacientes con queratocono se observó que las fibras nerviosas sub-basales exhibían configuraciones anormales en el vértice del cono. Los haces de fibras nerviosas en la región del ápice del cono tienden a adoptar orientaciones oblicuas u horizontales (fig. 1D). De hecho, el plexo nervioso se muestra como una red tortuosa de haces de fibras nerviosas, muchas de las cuales forman bucles cerrados52. En la base topográfica del cono, los haces de fibras nerviosas siguen un patrón concéntrico al cono. En un trabajo reciente, se analizaron por técnica asistida por inteligencia artificial imágenes de microscopía confocal (no superpuestas) del plexo nervioso sub-basal de pacientes sanos o con queratocono (usuarios y no usuarios de lentes de contacto)54. Para ello se estudiaron 390 imágenes de longitud de las fibras nerviosas corneales (corneal nerve fiber lenght, CNFL) y encontraron un valor significativamente inferior en el queratocono (16.4/1.9 mm/mm2) comparado con pacientes sin queratocono (23.8/3.3 mm/mm2). Incluso compararon el grupo control con los diferentes estadios del queratocono, ABDC de Belin y la de Amsler-Krumeinch54.
Aspectos bioquímicos en el queratocono
Durante el proceso de cicatrización corneal las células epiteliales, la lágrima y los nervios secretan mediadores, factores de crecimiento y factores neurotróficos que reparan y/o regeneran la herida. Los nervios corneales secretan diferentes mediadores neurales como SP, CGPR, VIP (vasointestinal peptide) que modula el trofismo, la regeneración y la inflamación50.
Entre ellos, destaca el primero en ser descrito, el factor de crecimiento nervioso (NGF). Lambiase describió en 2005 que los pacientes con queratocono carecen de TrkA (uno de los receptores fundamentales para la función del NGF) y tienen un incremento del factor de transcripción Sp3 (con capacidad represora), sugiriendo que esta alteración puede influir en la patogénesis del queratocono ya que los queratocitos (que normalmente expresan TrKA) no reciben señalización por parte del NGF55. Este mismo autor ha publicado trabajos donde se observa un incremento en la expresión de VIP y CGRP en los pacientes con queratocono56. En la figura 4 se individualizan las alteraciones que presentan los mediadores dentro del tejido corneal57.

Figura 4. Mediadores neuroquímicos en queratocono. Las flechas rojas representan su aumento y las azules, su descenso. Se muestran los mediadores conocidos a la fecha de realización de la presente revisión.
La sensibilidad corneal está disminuida en los pacientes con queratocono como se demuestra en varios estudios llevados a cabo con el estesiómetro de gas, que muestran un incremento del umbral y una disminución de la sensibilidad para estímulos mecánicos, térmicos y químicos en pacientes con queratocono comparados con voluntarios sanos58-59.
Tradicionalmente se ha considerado al queratocono como una ectasia no inflamatoria, pero actualmente varios estudios contradicen esta teoría demostrando un componente inflamatorio en el desarrollo de esta patología. En 2009, Lema y colaboradores analizaron el papel de la inflamación en la patogenia del queratocono, mostrando un aumento en los niveles de interleuquinas proinflamatorias IL-6, IL-1β e IFN-a, así́ como descenso en los niveles de la interleuquina antiinflamatoria IL-1060.
Existen estudios que muestran la correlación entre los mediadores inflamatorios de la lágrima y la severidad del queratocono. Kolozsvari y colaboradores estudiaron la relación entre las citoquinas inflamatorias presentes en la lágrima y la severidad del queratocono, encontrando una asociación positiva entre el ligando de la quimiocina 5 (CCL5) y el índice centro/periferia así como la relación entre la IL-6 y el valor de la queratometría máxima (KM)61. Estos investigadores también encontraron una asociación negativa entre los niveles de IL-13 y la severidad de la enfermedad y un incremento de los niveles del factor de crecimiento nervioso (NGF) en córneas con queratocono. Pastztor et al. observaron una asociación entre los diferentes valores de citoquinas y parámetros del Pentacam encontrando una fuerte correlación positiva entre la quimioquina CXCL8 y el índice de desviación de Belin-Ambrosio (BAD-D)62. Los niveles de metaloproteinasa 9 (MMP-9) se encontraban significativamente elevados en relación con el BAD-D y los valores queratométricos en el eje más curvo (K2).
Balasubramanian y colaboradores estudiaron la importancia de la proteólisis en el desarrollo y progresión del queratocono, encontrando niveles incrementados de colagenasas y gelatinasas (1,9 veces mayores que en el grupo control) así como metaloproteinasas (MMP-1, MMP-3, MMP-13), citoquinas (IL-6) y TNFα y TNFβ comparado con el grupo control63. Posteriormente completó el estudio evaluando el efecto del frotamiento ocular en la modificación de los niveles de proteinasas y citoquinas de la lágrima, encontrando un aumento significativo de la MMP-13 (que tiene un importante papel apoptótico) tras un frotamiento ocular de 60 segundos de duración64.
Los estudios más recientes han encontrado una correlación entre la progresión del queratocono y la presencia de inflamación a nivel sistémico, determinada a partir de índice neutrófilo/linfocito (neutrophil-to-lymphocyte ratio, NLR) que es mayor en pacientes que presentan progresión en relación con sujetos sanos65. Podría existir un círculo vicioso entre las citoquinas proinflamatorias, las enzimas proteolíticas y los inhibidores que son responsables de los cambios en el microambiente corneal en pacientes con queratocono. Este desequilibrio desencadena la activación de la cascada inflamatoria a nivel corneal produciendo cambios estructurales que condicionan la progresión de la enfermedad66.
Estrés oxidativo y queratocono
Cada vez existe un mayor interés por conocer el papel del estrés oxidativo. Los principales factores que protegen los tejidos oculares del daño inducido por el estrés oxidativo son la superóxido dismutasa (que protege frente a los radicales superóxido), antioxidantes de bajo peso molecular como el ácido ascórbico, el glutatión y los antioxidantes de elevado peso molecular (catalasa y glutation peroxidasa)67-68.
Un elemento clave en la fisiología corneal es neutralizar los radicales libres de oxígeno y agentes oxidantes que se producen de forma continuada a partir de la radiación UVA y moléculas procedentes del metabolismo celular.
Toprak y colaboradores fueron los primeros en evaluar el estrés oxidativo como factor predisponente de queratocono69. El desequilibrio entre la formación de radicales libres y su eliminación se encuentra alterado en estas córneas, lo que puede producir un aumento de la apoptosis de los queratocitos en estos sujetos70. Otros autores encontraron que la regulación a la alza de la IL-1α reduce la síntesis de dismutasa superóxido y daña la barrera antioxidante natural71.
Podríamos resumir que el factor neuroinflamatorio en la patogenia del queratocono sería compatible con:
Además, otros factores como el uso de lentes de contacto, alteraciones hormonales y ciertas enfermedades sistémicas pueden provocar, directa o indirectamente, el incremento de la inflamación, sin descartar también factores genéticos como la alteración en el receptor del NGF. En base a estas alteraciones anatómicas (menor inervación), funcionales (menor sensibilidad corneal) y bioquímicas (no poder “escuchar” a las señales neurotróficas) se podría establecer que los pacientes con queratocono realizan un frotamiento corneal más intenso para evocar la misma sensación que un paciente sin alteración de la sensibilidad corneal. Además, las córneas de los pacientes con queratocono no responderían a los factores tróficos neurogénicos como el NGF y tendrían alterados mecanismos de reparación neurotrófica de la córnea con incremento de mediadores de inflamación neurogénica.
Enfermedad neurodegenerativa
Por definición, las enfermedades neurodegenerativas son un grupo de afecciones que abarcan diversas patologías que causan la muerte progresiva de las neuronas y la pérdida sináptica en distintas regiones del sistema nervioso, que queda afectado73. También tienen en común procesos de neuroinflamación, déficit en diversos sistemas de neurotransmisores y modificaciones postraslacionales en distintas proteínas que dan lugar a un plegamiento anómalo o a su agregación73. Todo esto da lugar a los síntomas y signos característicos de cada una de ellas. Su etiología es desconocida, aparecen en edades más avanzadas, la mayoría de este tipo de enfermedades es de presentación esporádica y el aporte del componente hereditario es mínimo (inferior al 10%), aunque en algunas de estas sí que existe componente genético73. Estas enfermedades son incurables y debilitantes. El queratocono no está incluido dentro de ellas; sin embargo, por los datos analizados previamente en este trabajo, se destacan varios aspectos en común. El queratocono, ¿es acaso una enfermedad neurodegenerativa?
Potenciales implicancias clínicas
El estudio de la complejidad clínica que el queratocono presenta y los nuevos conocimientos que se tienen sobre esta patología, hacen que lo abordemos desde diferentes perspectivas terapéuticas:
Es fundamental conocer el origen de esta enfermedad, porque si seguimos pensando y asegurando que sólo es el rascado el responsable de estos trastornos, el tratamiento será la adaptación de collares isabelinos para los pacientes (fig. 5).

Figura 5. Esquema de una solución ficticia y cómica para evitar el rascado ocular mediante una barrera física, como son los “collares isabelinos” que se utilizan en mascotas para evitar que los animales puedan lamerse las heridas, autolesionarse o quitarse un vendaje postoperatorio
Ahora, si aceptamos la participación neuroinflamatoria como responsable e iniciadora del queratocono deberemos darle un lugar y probar la seguridad y eficacia —dentro de las opciones terapéuticas farmacológicas— al tratamiento médico con neuroprotectores. Podrían ser los “inhibidores de la calcineurina, la ciclosporina A tópica con tacrolimus y básicamente fármacos que estén en relación con los biomarcadores alterados (receptor del NGF, lisil-oxidasa, heparanasa). Quedan también otras posibles opciones como son los nuevos avances sobre la fotoneuroprotección con luz roja visible.
CONCLUSIONES
Para finalizar y luego de la extensa revisión realizada, se puntualizarán conceptos actuales y principales de este trabajo como conclusiones.
1. El sector anterior de la córnea (que se encuentra por delante de la capa de los troncos nerviosos) constituye una unidad funcional o “supersistema” en sí misma que se comporta como una gran terminación nerviosa (fig. 3), otorgándole la más alta sensibilidad del organismo gracias a la profusa inervación existente en el plexo subepitelial, imbricado por miles de terminaciones intraepiteliales.
2. El plexo nervioso sub-basal, mediante su integridad funcional, es responsable de regular o coordinar el ciclo del parpadeo en un conjunto armónico para la defensa del ojo y la lubricación de la superficie anterior.
3. El plexo sub-basal, mediante sus terminaciones nerviosas, también es responsable de mantener el trofismo celular, reparar rápidamente el daño y colaborar activamente en mantener la transparencia corneal.
4. Los axones tienen la capacidad de cambiar la dirección, su grosor y su flujo según los estímulos compresivos que reciban y que también sufren cambios por la edad en su cantidad y en su volumen (fig. 1B).
5. Se subraya que el compromiso de todo el plexo nervioso sub-basal en el queratocono se comprueba por sus alteraciones anatómicas, fisiológicas y bioquímicas, liderado en gran parte por el roce ocular, aunque puede presentarse sin tenerlo.
6. Las alteraciones bioquímicas que se encuentran en el estroma son lideradas por cambios en el plexo sub-basal o de sus componentes axonales.
7. Si bien no se encuentra catalogada como una enfermedad neurodegenerativa, comparte con ellas varios aspectos ligados a la neuroinflamación.
Para terminar, si bien el roce vigoroso ha sido tradicionalmente y sigue siendo el método principal para justificar la aparición o evolución de la ectasia, múltiples estudios más actuales que incluyen marcadores genéticos, mediadores inflamatorios, neuroquímicos, factores autoinmunes o neurodegenerativos, conducen a pensar que el queratocono, más allá de ser una patología derivada de un estímulo mecánico, se comporta como un verdadero síndrome multifactorial que requiere, quizás, de un cambio de paradigma en plantear su génesis, todavía de extensa investigación para abordar de forma firme su conocimiento y su tratamiento efectivo.
BIBLIOGRAFÍA
1. Bawazeer AM, Hodge WG, Lorimer B et al. Atopy and keratoconus: a multivariate analysis. Br J Ophalmol 2000; 84: 834-836.
2. Shetty R, Sureka S, Kusumgar P et al. Allergen- specific exposure associated with high immunoglobulin E and eye rubbing predisposes to progression of keratoconus. Indian J Ophthalmol 2017; 65: 399-402.
3. Hawkes E, Nanavaty MA. Eye rubbing and keratoconus: a literature review. Int J Keratoconus Ectatic Corneal Dis 2014; 3: 118-121.
4. Najmi H, Mobarki Y, Mania K et al. The correlation between keratoconus and eye rubbing: a review. Int J Ophthalmol 2019; 12: 1775-1781.
5. Ben-Eli H, Erdinest N, Solomon A. Pathogenesis and complications of chronic eye rubbing in ocular allergy. Curr Opin Allergy Clin Immunol 2019; 19: 526-534.
6. McMonnies CW. Mechanisms of rubbing-related corneal trauma in keratoconus. Cornea 2009; 28: 607-615.
7. Galvis V, Tello A, Carreño NI et al. Risk factors for keratoconus: atopy and eye rubbing. Cornea 2017; 36: e1.
8. Yusuf IH, Salmon JF. Iridoschisis and keratoconus in a patient with severe allergic eye disease and compulsive eye rubbing: a case report. J Med Case Rep 2016; 10: 134.
9. Shneor E, Millodot M, Blumberg S et al. Characteristics of 244 patients with keratoconus seen in an optometric contact lens practice. Clin Exp Optom 2013; 96: 219-224.
10. McGhee CN, Kim BZ, Wilson PJ. Contemporary treatment paradigms in keratoconus. Cornea 2015; 34 (Suppl 10): S16-S23.
11. AlShammari Z, AlShammari R, AlOrf S et al. Prevalence, clinical features and associated factors of keratoconus patients attending Ophthalmology Department, King Khalid Hospital, Hail City, Saudi Arabia. EC Ophthalmology 2016; 3: 388-400.
12. Rabinowitz YS. Keratoconus. Surv Ophthalmol 1998; 42: 297-319.
13. Sugar J, Macsai MS. What causes keratoconus? Cornea 2012; 31: 716-719.
14. Rabinowitz YS, Galvis V, Tello A et al. Genetics vs chronic corneal mechanical trauma in the etiology of keratoconus. Exp Eye Res 2020 Oct 24:108328.
15. Ihalainen A. Clinical and epidemiological features of keratoconus genetic and external factors in the pathogenesis of the disease. Acta Ophthalmol Suppl 1986; 178: 1-64.
16. Rabinowitz YS, Zu H, Yang Y et al. Keratoconus: further gene linkage studies on chromosome 21. Invest Ophthalmol Vis Sci 2000; 41 (Suppl.): 2863.
17. Gordon-Shaag A, Millodot M, Shneor E, Liu Y. The genetic and environmental factors for keratoconus. Biomed Res Int 2015; 2015:795738.
18. Karolak JA, Gajecka M. Genomic strategies to understand causes of keratoconus. Mol Genet Genomics 2017; 292: 251-269.
19. Bechara SJ, Waring 3rd GO, Insler MS. Keratoconus in two pairs of identical twins. Cornea 1996; 15: 90-93.
20. McMahon TT, Shin JA, Newlin A et al. Discordance for keratoconus in two pairs of monozygotic twins. Cornea 1999; 18: 444-451.
21. Owens H, Gamble G. A profile of keratoconus in New Zealand. Cornea 2003; 22: 122-125.
22. Millodot M, Shneor E, Albou S et al. Prevalence and associated factors of keratoconus in Jerusalem: a cross-sectional study. Ophthalmic Epidemiol 2011; 18: 91-97.
23. Müller LJ, Marfurt CF, Kruse F, Tervo TMT. Corneal nerves: structure, contents and function. Exp Eye Res 2003; 76: 521-542.
24. Yang AY, Chow J, Liu J. Corneal innervation and sensation: the eye and beyond. Yale J Biol Med 2018; 91: 13-21.
25. Turner WA. The results of section of the trigeminal nerve, with reference to the so-called “trophic” influence of the nerve on the cornea. Br Med J 1895; 2: 1279-1280.
26. Patel DV, McGhee CNJ. Mapping of the normal human corneal sub-basal nerve plexus by in vivo laser scanning confocal microscopy. Invest Ophthalmol Vis Sci 2005; 46: 4485-4488.
27. Kokot J, Wylęgała A, Wowra B et al. Corneal confocal sub-basal nerve plexus evaluation: a review. Acta Ophthalmol 2018; 96: 232-242.
28. Berson E. Electrical phenomena in the retina. En: Moses R. (ed.). Adler’s Physiology of the eye and clinical applications. 7th ed. London: C. V. Mosby, 1981, p. 507-509.
29. Dua HS, Watson NJ, Mathur RM, Forrester JV. Corneal epithelial cell migration in humans: “hurricane and blizzard keratopathy”. Eye (Lond) 1993; 7: 53-58.
30. Yaprak M. The axon reflex. Neuroanatomy 2008; 7: 17-19.
31. Al-Aqaba MA, Dhillon VK, Mohammed I et al. Corneal nerves in health and disease. Prog Retin Eye Res 2019; 73: 100762.
32. Koaik M, Baig K. Corneal neurotization. Curr Opin Ophthalmol 2019; 30: 292-298.
33. Perry KJ, Hamilton PW, Sonam S et al. The role of sensory innervation in cornea-lens regeneration. Dev Dyn 2019; 248: 530-544.
34. Labetoulle M, Baudouin C, Calonge M et al. Role of corneal nerves in ocular surface homeostasis and disease. Acta Ophthalmol 2019; 97: 137-145.
35. Wilson WS, McKean CE. Regional distribution of acetylcholine and associated enzymes and their regeneration in corneal epithelium. Exp Eye Res 1986; 43: 235-242.
36. Chernyavsky AI, Galitovskiy V, Shchepotin IB et al. The acetylcholine signaling network of corneal epithelium and its role in regulation of random and directional migration of corneal epithelial cells. Invest Ophthalmol Vis Sci 2014 Sep 30; 55: 6921-6933.
37. Langley JN. Antidromic action. Part II: stimulation of the peripheral nerves of the cat’s hind foot. J Physiol 1923; 58: 49-69.
38. Lewis T. The blood vessels of the human skin and their responses. London: Shaw & Sons, 1927.
39. Chiu IM, von Hehn CA, Woolf CJ. Neurogenic inflammation and the peripheral nervous system in host defense and immunopathology. Nat Neurosci 2012; 15: 1063-1067.
40. Columbo M, Horowitz EM, Kagey-Sobotka A, Lichtenstein LM. Substance P activates the release of histamine from human skin mast cells through a pertussis toxin-sensitive and protein kinase C-dependent mechanism. Clin Immunol Immunopathol 1996; 81: 68-73.
41. Ansel JC, Brown JR, Payan DG, Brown MA. Substance P selectively activates TNF-alpha gene expression in murine mast cells. J Immunol 1993; 150: 4478-4485.
42. Mikami N, Matsushita H, Kato T et al. Calcitonin gene-related peptide is an important regulator of cutaneous immunity: effect on dendritic cell and T cell functions. J Immunol 2011; 186: 6886-6893.
43. van der Kleij HPM, Forsythe P, Bienenstock J. Autonomic neuroimmunology. En: Squire LR (ed.). Encyclopedia of neuroscience. London: Academic Press, 2009, p. 1003-1008.
44. Gambato C, Longhin E, Catania AG et al. Aging and corneal layers: an in vivo corneal confocal microscopy study. Graefes Arch Clin Exp Ophthalmol 2015; 253: 267-275.
45. Barbariga M, Rabiolo A, Fonteyne P et al. The effect of aging on nerve morphology and substance P expression in mouse and human corneas. Invest Ophthalmol Vis Sci 2018; 59: 5329-5335.
46. Stapleton F, Chao C, Golebiowski B. Effects of contact lens wear on corneal, conjunctival, and lid margin sensitivity. Optom Vis Sci 2019; 96: 790-801.
47. Jin W, Ye J, Zhang J et al. Short-term effects of overnight orthokeratology on corneal sensitivity in Chinese children and adolescents. J Ophthalmol 2018; 2018: 6185919.
48. Lum E, Golebiowski B, Swarbrick HA. Changes in corneal subbasal nerve morphology and sensitivity during orthokeratology: recovery of change. Ocul Surf 2017; 15: 236-241.
49. Nombela-Palomo M, Felipe-Marquez G, Teus MA et al. Long-term impacts of orthokeratology treatment on sub-basal nerve plexus and corneal sensitivity responses and their reversibility. Eye Contact Lens 2018; 44: 91-96.
50. Wilson SE. Corneal wound healing. Exp Eye Res 2020; 197:108089.
51. Krachmer JH, Feder RS, Belin MW. Keratoconus and related noninflammatory corneal thinning disorders. Surv Ophthalmol 1984; 28: 293-322.
52. Pahuja NK, Shetty R, Nuijts RMMA et al. An in vivo confocal microscopic study of corneal nerve morphology in unilateral keratoconus. Biomed Res Int 2016; 2016: 5067853.
53. Patel DV, McGhee CNJ. Mapping the corneal sub-basal nerve plexus in keratoconus by in vivo laser scanning confocal microscopy. Invest Ophthalmol Vis Sci 2006; 47: 1348-1351.
54. Flockerzi E, Daas L, Seitz B. Structural changes in the corneal subbasal nerve plexus in keratoconus. Acta Ophthalmol 2020. doi: 10.1111/aos.14432. En línea, previo a impresión.
55. Lambiase A, Merlo D, Mollinari C et al. Molecular basis for keratoconus: lack of TrkA expression and its transcriptional repression by Sp3. Proc Natl Acad Sci USA 2005; 102: 16795-16800.
56. Sacchetti M, Scorcia V, Lambiase A, Bonini S. Preliminary evidence of neuropeptides involvement in keratoconus. Acta Ophthalmol 2015; 93: e315-e316.
57. Martínez Afanador AM, Urrea-Victoria T. Revisión de queratocono y su enfoque como enfermedad inflamatoria. Rev Soc Colomb Oftalmol 2015; 48: 246-255.
58. Merayo J, Portero A, Galarreta D et al. Measurement of corneal sensitivity in normal, contact lenses and keratoconus patients with the Belmonte Ocular Pain Meter (BPM), a commercial model of the Belmonte non-contact gas esthesiometer in normal, contact lenses and keratoconus patiens. Invest Ophthalmol Vis Sci 2008; 49 (suppl): ARVO e-abstrat 4347.
59. Dienes L, Kiss HJ, Perényi K et al. Corneal sensitivity and dry eye symptoms in patients with keratoconus. PLoS One 2015; 10: e01141621.
60. Lema I, Sobrino T, Duran JA et al. Subclinical keratoconus and inflammatory molecules from tears. Br J Ophthalmol 2009; 93: 820-824.
61. Kolozsvári BL, Petrovski G, Gogolák P et al. Association between mediators in the tear fluid and the severity of keratoconus. Ophthalmic Res 2014; 51: 46-51.
62. Pásztor D, Kolozsvári BL, Csutak A et al. Tear mediators in corneal ectatic disorders. PLoS One 2016; 11: e0153186.
63. Balasubramanian SA, Mohan S, Pye DC, Willcox MDP. Proteases, proteolysis and inflammatory molecules in the tears of people with keratoconus. Acta Ophthalmol 2012; 90: e303-e309.
64. Balasubramanian SA, Wasinger VC, Pye DC, Willcox MDP. Preliminary identification of differentially expressed tear proteins in keratoconus. Mol Vis 2013; 19: 2124-2134.
65. Karaca EE, Özmen MC, Ekici F et al. Neutrophil-to-lymphocyte ratio may predict progression in patients with keratoconus. Cornea 2014; 33: 1168-1173.
66. Wisse RPL, Kuiper JJW, Gans R et al. Cytokine expression in keratoconus and its corneal microenvironment: a systematic review. Ocul Surf 2015; 13: 272-283.
67. Shetty R, Sharma A, Pahuja N et al. Oxidative stress induces dysregulated autophagy in corneal epithelium of keratoconus patients. PLoS One 2017; 12: e0184628.
68. Balmus IM, Alexa AI, Ciuntu RE et al. Oxidative stress markers dynamics in keratoconus patients’ tears before and after corneal collagen crosslinking procedure. Exp Eye Res 2020; 190: 107897.
69. Toprak I, Kucukatay V, Yildirim C et al. Increased systemic oxidative stress in patients with keratoconus. Eye (Lond) 2014; 28: 285-289.
70. Matthews FJ, Cook SD, Majid MA et al. Changes in the balance of the tissue inhibitor of matrix metalloproteinases (TIMPs)-1 and -3 may promote keratocyte apoptosis in keratoconus. Exp Eye Res 2007; 84: 1125-1134.
71. Olofsson EM, Marklund SL, Pedrosa-Domellöf F, Behndig A. Interleukin-1alpha downregulates extracellular-superoxide dismutase in human corneal keratoconus stromal cells. Mol Vis 2007; 13: 1285-1290.
72. Merayo J. El queratocono como enfermedad inflamatoria. En: Peris Martínez C, Alejandre Alba N, Abengózar Vela A. Actualización en queratocono. Barcelona: Editorial Glosa, 2017, p. 51-55. (Sociedad de Superficie Ocular y Córnea, GESOC).
73. Hou Y, Dan X, Babbar M et al. Ageing as a risk factor for neurodegenerative disease. Nat Rev Neurol 2019; 15: 565-581.