REPORTE DE CASO
Absceso corneal de evolución tórpida
Diego Desioa, b, Patricio Grayebb, Fernando Pellegrinob, Diego Ramírez Arduha, Esperanza Gabrielaa, Norma Apesteyb, Paula Anauatib, Federico Guisasolab
a Centro de la Visión, Paraná, Entre Ríos, Argentina.
b Hospital Oftalmológico Santa Lucía, Buenos Aires.
Recibido: 2 de julio de 2020.
Aprobado: 2 de agosto de 2020.
Correspondencia
Dr. Diego D. Desio
Malvinas 91
(3100) Paraná, Entre Ríos.
+54 0343 423 2405
diegodesio@hotmail.com
Oftalmol Clin Exp (ISSN 1851-2658)
2020; 13(3): 166-172.
RESUMEN
Objetivo: Presentar un caso clínico complejo de queratitis infecciosa de difícil tratamiento.
Caso clínico: Paciente de 35 años de edad de sexo femenino con absceso corneal avanzado de evolución tórpida en ojo derecho. Tras toma de muestras (raspado corneal para examen directo, microbiológico, cultivo y antibiograma) y tratamiento empírico con colirios fortificados, se requirió realizar recubrimiento conjuntival y trasplantes de córnea en cuatro ocasiones, además de una cirugía de cataratas 8 meses luego del último trasplante, hasta lograr la resolución de la infección. Se identificaron como agentes causales: Staphylococcus aureus, hongos universales y Acanthamoeba spp.
Conclusión: Ante la evolución errática en queratitis infecciosa, se debe sospechar su origen polimicrobiano y utilizar todos los recursos terapéuticos y clínico-quirúrgicos para su resolución. Se subraya la importancia de intentar la identificación del agente causal para realizar un tratamiento específico.
Palabras clave: absceso corneal, queratitis infecciosa, recubrimiento conjuntival, injerto corneal.
Corneal abscess of torpid evolution
ABSTRACT
Objective: To report a complex clinical case of difficult-to-treat infectious keratitis.
Clinical case: Thirty-five-year-old female patient with an advanced corneal abscess of torpid evolution in her right eye. After sample collection (corneal scraping for direct and microbiological examination, culture and antibiogram) and empirical treatment with fortified eye drops, conjunctival flaps and corneal grafts were required on four occasions, in addition to cataract surgery 8 months after the last graft, until resolution of the infection was achieved. The causative agents identified were: Staphylococcus aureus, universal fungi and Acanthamoeba spp.
Conclusion: When faced with a case of infectious keratitis of erratic evolution, a polymicrobial origin should be suspected and all the therapeutic and clinico-surgical resources should be used for its resolution. The importance of trying to identify the causative agent involved in order to administer specific therapy is hereby stressed.
Keywords: corneal abscess, infectious keratitis, conjunctival flap, corneal graft.
Abscesso de córnea de evolução tórpida
RESUMO
Objetivo: Apresentar um caso clínico complexo de ceratite infecciosa de difícil tratamento.
Caso clínico: Paciente de 35 anos de idade de sexo feminino com abscesso de córnea avançado de evolução tórpida em olho direito. Após colheita de amostras (raspagem da córnea para exame direto, microbiológico, cultura e antibiograma) e tratamento empírico com colírios fortificados, foi preciso realizar revestimento conjuntival e transplantes de córnea em quatro ocasiões, além de uma cirurgia de cataratas 8 meses logo do último transplante, até obter a resolução da infeção. Identificaram-se como agentes causais: Staphylococcus aureus, fungos universais e Acanthamoeba spp.
Conclusão: Frente à evolução inestável em ceratite infecciosa, se deve suspeitar sua origem polimicrobiano e utilizar todos os recursos terapêuticos e clínico-cirúrgicos para sua resolução. Se salienta a importância de intentar a identificação do agente causal para realizar um tratamento específico.
Palavras chave: abscesso de córnea, ceratite infecciosa, revestimento conjuntival, enxerto corneal.
INTRODUCCIÓN
La afectación de la córnea por agentes infecciosos puede tener efectos devastadores para la visión, pudiendo afectar la transparencia e incluso la estructura corneal, debilitándola hasta su perforación1. Generalmente las queratitis infecciosas severas suelen producirse en ojos con factores predisponentes, como pueden ser diferentes enfermedades crónicas de superficie ocular2-3, antecedentes de cirugías corneales o que hayan atravesado la córnea4 o en pacientes usuarios de lentes de contacto5-6. También resulta importante el antecedente de traumatismo ocular y cualquier situación que pueda generar una ruptura del epitelio o altere la homeostasis del sistema de defensa ocular3.
En lo que respecta a sus agentes causales, las más frecuentes son las queratitis bacterianas, que representan entre el 65% y el 90% de las infecciones corneales, y en su mayoría son producidas por especies cocos Gram positivos (80%)7-9. Las infecciones fúngicas representan entre el 10% y el 15% en países en vías de desarrollo10-11. La incidencia de nuevas queratitis por HSV (enfermedad tanto epitelial como estromal) es de 18 a 25 por 100.000 con tasas de recurrencia estimadas en 50% a los 5 años y más de 60% a los 20 años12-13. Dentro de las queratitis por parásitos, las amebas del género Acanthamoeba son agentes causales de una infección corneal grave y difícil de diagnosticar con una prevalencia estimada de 1-9 en cien mil14-15. Un porcentaje variable (3%-21%) de los casos es polimicrobiano, combinando distintas bacterias, hongos o amebas6-9, 11.
Por lo tanto, el objetivo de este trabajo es presentar un caso clínico de un paciente con un absceso de córnea de difícil manejo y describir su evolución clínica, diagnósticos etiológicos en contexto polimicrobiano y su tratamiento clínico-quirúrgico.
CASO CLÍNICO
Se presenta a la consulta una paciente de sexo femenino de 35 años de edad que refiere dolor ocular derecho de un mes de evolución. El antecedente asociado era que en el trabajo (oficinista) le entró una “basurita” en el ojo derecho. Concurrió a varias consultas oftalmológicas donde le indicaron múltiples colirios/ungüentos (ciprofloxacina 0.3%, moxifloxacina 0.5%, eritromicina 1% ungüento, ganciclovir 0.15%, atropina 1%) durante 30 días, sin haber notado mejoría. Anteriormente sus controles oftalmológicos habían sido normales, según refirió.
En la evaluación oftalmológica, la agudeza visual del ojo izquierdo era normal (10/10) sin corrección y tenía visión bulto en el ojo afectado, donde se observaba la presencia de un absceso corneal de forma anular central mayor a 6 milímetros con gran adelgazamiento del estroma corneal central y compromiso de cámara anterior (fig. 1). Ante este aspecto, como posibles diagnósticos diferenciales se postularon los siguientes: infección por Pseudomonas, Acanthamoeba, micosis, herpes y abuso de anestésicos. La paciente negó el uso de anestésicos tópicos y de lentes de contacto (ni con graduación, ni cosméticos).
Se realizó toma de muestras mediante raspado corneal para examen de directo y de estudio microbiológico (cultivo y antibiograma) y comenzar con tratamiento de colirios fortificados de vancomicina 50 mg/ml y ceftazidima 50 mg/ml cada hora y ganciclovir 0.15% cada 4 horas. A las 72 horas, el directo y cultivo fueron negativos y, debido a la mala evolución del cuadro, se decidió realizar recubrimiento conjuntival y tenoniano bipediculado.
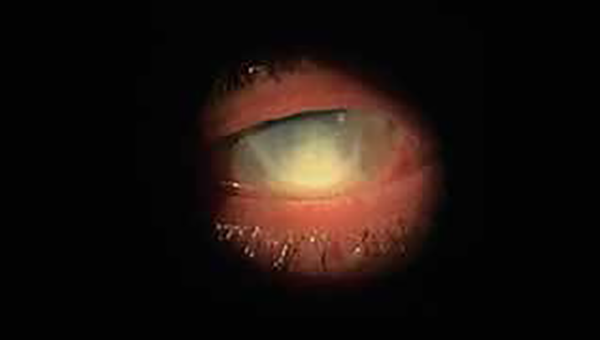
Figura 1. Infiltrado corneal anular con afectación de la cámara anterior.
Se mantuvieron antibióticos fortificados tópicos por 2 meses y luego controles frecuentes. A los 6 meses del recubrimiento conjuntival se presentó de urgencia por molestias y se diagnosticó perforación corneal central (fig. 2). Se decidió realizar un injerto corneal en caliente de 7.50 mm de diámetro. Se tomaron muestras por raspado corneal para directo y cultivo que informó presencia de estafilococo aureus sensible a vancomicina. Se reinició tratamiento con colirios fortificados de vancomicina 50 mg/ml y ceftazidima 50 mg/ml cada dos horas, que luego se fueron disminuyendo gradualmente hasta mantener en tres veces por día. Se utilizó también prednisolona acetato 10 mg/ml cada seis horas y atropina 1% cada doce horas.

Figura 2. Perforación corneal. Nótese el recubrimiento conjuntival previamente realizado.
A mes del injerto, comenzó en la córnea receptora un infiltrado anular que avanzó centrípetamente. Su evolución terminó en una nueva perforación, en el sector de la unión donante receptor, a nivel inferior (fig. 3). Se indicó un segundo injerto corneal en caliente, esta vez de 8.00 mm de diámetro. Se tomaron nuevas muestras para análisis microbiológico y PCR para hongos. Ante la sospecha de una coinfección corneal por hongos se inició, junto con el tratamiento previo, una terapia tópico-empírica con colirios de anfotericina 50mg/ml, voriconazol 1% y fluconazol cada dos horas, además de fluconazol 200 mg por vía oral cada doce horas. Los resultados del directo y cultivo fueron negativos y la PCR para hongos no se pudo realizar por motivos económicos.

Figura 3. Infiltración corneal sobre injerto corneal y en la zona de unión, en el primer transplante realizado.
A los 30 días del segundo injerto se volvió a ver un infiltrado estromal en la unión donante-receptor por lo que se decidió realizar inyecciones intraestromales e intracamerales de anfotericina 10 μg, dos dosis separadas por una semana. Pero a pesar de los tratamientos al mes y 5 días se observó una nueva perforación corneal en la unión donante-receptor a nivel inferior (fig. 4).
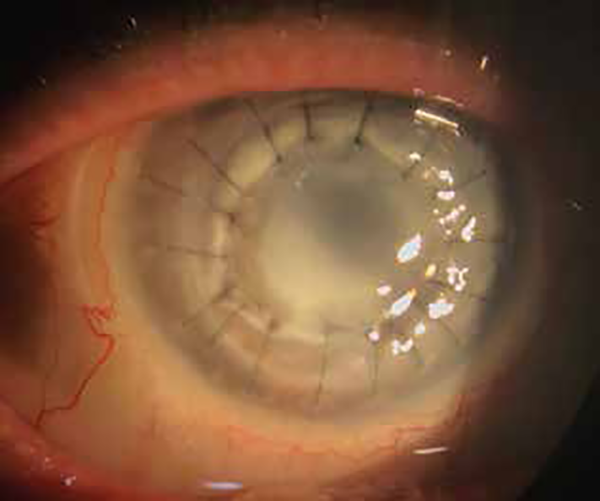
Figura 4. Colagenolisis periférica y pérdida de estructura (perforación) en el segundo transplante de córnea realizado.
Se realizó un tercer injerto corneal en caliente de mayor diámetro (8.5 mm). Se tomaron muestras para análisis con PCR y anatomía patológica. El resultado de la PCR a las 24 horas fue positivo para hongos universales sin poder identificar el tipo de hongo. A los 9 días el resultado de la anatomía patológica informó quistes de Acanthamoeba (recordamos que la paciente no era usuaria de lentes de contacto) y al mismo tiempo el examen directo informó la presencia de quistes de Acanthamoeba. Se continuó con el mismo tratamiento local y oral pero se agregó polihexametileno biguanida (PHMB) al 0.02% y clorhexidina 0.02%, ambas de forma tópica y a cada hora.
La evolución del tercer injerto corneal parecía ser favorable sin evidencia de recidiva del absceso corneal en la córnea receptora. Pero a pesar de haber estado manteniendo el tratamiento tópico, dos meses más tarde apareció un infiltrado corneal en la unión donante receptor y a nivel central (fig. 5).
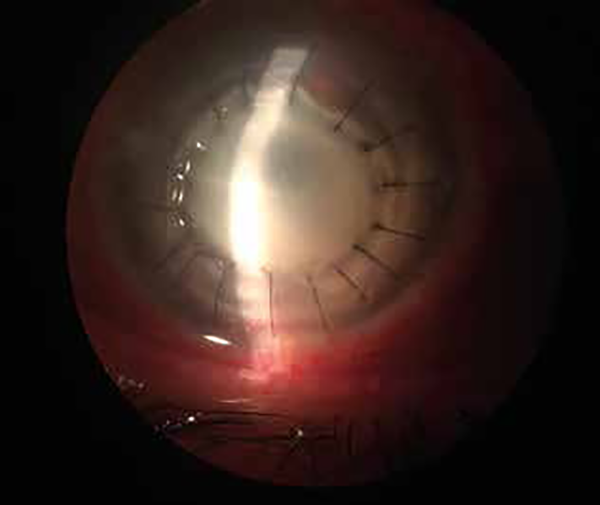
Figura 5. Recidiva de la infección en el tercer transplante corneal.
Ante tan mala evolución, 15 días después se realizó un cuarto injerto corneal “en caliente” de 8.5 mm.
La evolución del último injerto corneal fue favorable en el tiempo y sin signos de recidiva de la infección. El examen del segmento anterior presentaba adherencia iridocorneal periférica sectorial, sinequias posteriores y catarata. Se continuó con PHMB 0.02%, clorhexidina 0.02% y voriconazol cada 6 horas y Prednefrin Forte cada 12 horas por 6 meses. A los 8 meses del último injerto corneal (y a 13 meses y 9 días del primero) se realizó cirugía de catarata con implante de LIO (fig. 6).
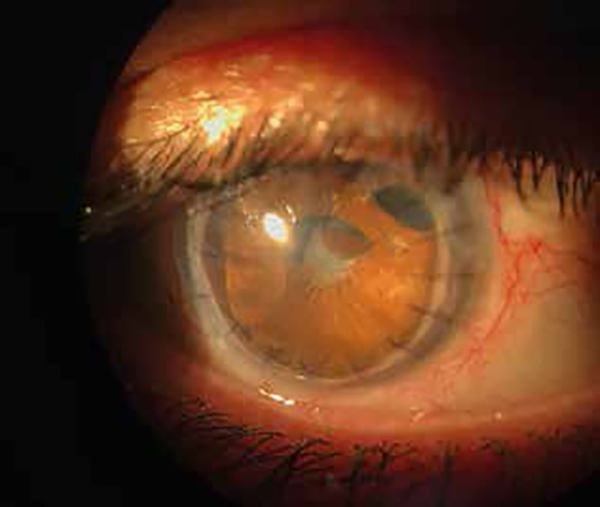
Figura 6. Aspecto en pseudofaquia, con tejido corneal transparente y sin signos de infección tras el cuarto transplante corneal.

Figura 7. Aspecto en pseudofaquia, con tejido corneal transparente y sin signos de infección tras el cuarto transplante corneal.
Actualmente la visión es de cuenta dedos a un metro, su presión ocular promedio es de 18 mmHg con tratamiento antiglaucomatoso preventivo (timolol 0.5% cada 12 horas) y el fondo de ojos se mantiene sano, sin haberse alterado en todo el proceso.
Tras haber logrado resolver finalmente la patología infecciosa, se programa para un futuro cercano procedimiento refractivo para mejorar su resultado visual y el estricto control de la presión ocular, sin poder descartar la necesidad de una cirugía de glaucoma en el mediano plazo.
DISCUSIÓN
La queratitis infecciosa puede llevar a una disfunción visual severa si no se realiza un correcto diagnóstico etiopatogénico y un tratamiento adecuado. En ciertas partes del mundo es parte de un serio problema de salud pública1. La identificación oportuna de los patógenos causantes del problema y la aplicación de la terapéutica anti-infecciosa apropiada son factores clave para un exitoso manejo de la queratitis infecciosa.
En relación con el caso clínico presentado, la paciente cursó claramente con una queratitis infecciosa polimicrobiana de difícil diagnóstico. Varios aspectos pueden discutirse respecto de la evolución tórpida observada. En un comienzo, una mala interpretación clínica de la queratitis, tal vez influenciada por la ausencia del factor de riesgo del uso de lentes de contacto (respecto de la etiología asociada a la ameba) que motivó una ineficaz selección inicial de los colirios anti-infecciosos. Respecto de la toma de muestra inicial, se podría pensar que se obtuvo escaso material de raspado corneal para análisis y también se podría tener dudas sobre el tamaño del primer injerto corneal en caliente, que podría haber sido más grande. Pero hay un punto muy importante que condicionó, a nuestro entender, la mala evolución del caso clínico y fue la falta de identificación a tiempo de los gérmenes causales.
La identificación de “el o los” germen/es causante/s de la queratitis infecciosa resulta un reto diagnóstico debido a varios factores: por un lado, no existen signos específicos que puedan asegurar con total sensibilidad y especificidad el diagnóstico “clínico” de los agentes causales7, 16; por otro lado, la recolección de la muestra puede ser errónea o escasa, motivo por el cual en el 30-35% de los casos no se aíslan microorganismos en los directos y cultivos17. Si bien existen estudios moleculares como la PCR18-19 y estudios por imágenes como la microscopía confocal19, a veces resulta de difícil acceso y también pueden tener falsos positivos y negativos.
Finalmente, el estudio patológico del material extraído en las biopsias corneales no es simple de informar y se requiere un especialista en patología que esté acostumbrado a evaluar muestras oculares16-17. Por todo lo anterior, sumado al difícil acceso a los colirios “anti-infecciosos” fortificados de preparación magistral (por disponibilidad y el costo de algunos productos), más el incumplimiento del tratamiento por parte del paciente —ya que a veces no puede mantener la carga horaria de la posología establecida—, hace que a veces la evolución de las queratitis infecciosas sea complicada e incierta.
A pesar de que en más del 65% de los casos las queratitis infecciosas son de origen bacteriano y a su vez estas son causadas en un 80% por especies cocos Gram positivos7-8, siempre es necesario estar alerta con respecto de la posibilidad de estar en presencia de otro agente causal o de una infección corneal polimicrobiana y no caer en el “hábito” de la presunción y el tratamiento puramente empírico; ya que, aunque se tiende a creer que las decisiones se toman luego de evaluar distintas alternativas, O’Hare y colaboradores demostraron en la Universidad de Duke de Estados Unidos que más del 40% de las acciones que realiza una persona promedio responde a hábitos antes que a decisiones conscientes20.
CONCLUSIÓN
A pesar de que el examen oftalmológico y los antecedentes del paciente son de mucha utilidad para aproximarse al agente causal, el reto clínico consiste en poder identificar el germen causal mediante exámenes microbiológicos, anatomía patológica, métodos moleculares (PCR) y microscopía confocal, ya que no existen signos clínicos específicos que confirmen la causa etiológica del germen causante. El plan terapéutico, luego de la toma de muestra corneal, se iniciará empíricamente basándose en los factores de riesgo, el aspecto del examen clínico y potenciales patógenos corneales hasta poder dilucidar el agente causal.
Se concluye que el examen oftalmológico y la cronología de los hechos son de suma importancia en las queratitis infecciosas pero la identificación del germen causante es el pilar esencial para el correcto tratamiento y evolución favorable de esta patología.
REFERENCIAS
1. Ung L, Bispo PJM, Shanbhag SS et al. The persistent dilemma of microbial keratitis: global burden, diagnosis, and antimicrobial resistance. Surv Ophthalmol 2019; 64: 255-271.
2. Na KS, Hwang KY, Lee HS et al. Wakayama symposium: interface between innate and adaptive immunity in dry eye disease. BMC Ophthalmol 2015; 15 (Suppl 1): 159.
3. Pérez del Palomar A, Montolío A, Cegoñino J et al. The innate immune cell profile of the cornea predicts the onset of ocular surface inflammatory disorders. J Clin Med 2019; 8: 2110.
4. Schallhorn JM, Schallhorn SC, Hettinger K, Hannan S. Infectious keratitis after laser vision correction: incidence and risk factors. J Cataract Refract Surg 2017; 43: 473-479.
5. Stapleton F, Naduvilath T, Keay L et al. Risk factors and causative organisms in microbial keratitis in daily disposable contact lens wear. PLoS One 2017; 12: e0181343.
6. Masters J, Kocak M, Waite A. Risk for microbial keratitis: comparative metaanalysis of contact lens wearers and post-laser in situ keratomileusis patients. J Cataract Refract Surg 2017; 43: 67-73.
7. Grandi G, Bianco G, Boattini M et al. Bacterial etiology and antimicrobial resistance trends in ocular infections: a 30-year study, Turin area, Italy. Eur J Ophthalmol 2019; (en prensa).
8. Acharya M, Farooqui JH, Gaba T et al. Delhi infectious keratitis study: update on clinico-microbiological profile and outcomes of infectious keratitis. J Curr Ophthalmol 2020; 32: 249-255.
9. Ibrahim MM, Vanini R, Ibrahim FM et al. Epidemiology and medical prediction of microbial keratitis in southeast Brazil. Arq Bras Oftalmol 2011; 74: 7-12.
10. Mahmoudi S, Masoomi A, Ahmadikia K et al. Fungal keratitis: an overview of clinical and laboratory aspects. Mycoses 2018; 61: 916-930.
11. Manikandan P, Abdel-Hadi A, Singh YRB et al. Fungal keratitis: epidemiology, rapid detection, and antifungal susceptibilities of Fusarium and Aspergillus isolates from corneal scrapings. Biomed Res Int 2019; 2019: 6395840.
12. Rowe AM, St Leger AJ, Jeon S et al. Herpes keratitis. Prog Retin Eye Res 2013; 32: 88-101.
13. Lobo AM, Agelidis AM, Shukla D. Pathogenesis of herpes simplex keratitis: the host cell response and ocular surface sequelae to infection and inflammation. Ocul Surf 2019; 17: 40-49.
14. Maycock NJR, Jayaswal R. Update on Acanthamoeba keratitis: diagnosis, treatment, and outcomes. Cornea 2016; 35: 713-720.
15. Khurana S, Sharma M. Parasitic keratitis: an under-reported entity. Trop Parasitol 2020; 10: 12-17. Kaye SB, Rao PG, Smith G et al. Simplifying collection of corneal specimens in cases of suspected bacterial keratitis. J Clin Microbiol 2003; 41: 3192-3197.
16. Moshirfar M, Hopping GC, Vaidyanathan U et al. Biological staining and culturing in infectious keratitis: controversy in clinical utility. Med Hypothesis Discov Innov Ophthalmol 2019; 8: 145-151.
17. Kaye SB, Rao PG, Smith G et al. Simplifying collection of corneal specimens in cases of suspected bacterial keratitis. J Clin Microbiol 2003; 41: 3192-3197.
18. Liu HY, Hopping GC, Vaidyanathan U et al. Polymerase chain reaction and its application in the diagnosis of infectious keratitis. Med Hypothesis Discov Innov Ophthalmol 2019; 8: 152-155.
19. Goh JWY, Harrison R, Hau S et al. Comparison of In vivo confocal microscopy, PCR and culture of corneal scrapes in the diagnosis of Acanthamoeba keratitis. Cornea 2018; 37: 480-485.
20. O’Hare J, Calakos N, Yin HH. Recent insights into corticostriatal circuit mechanisms underlying habits: invited review for current opinions in behavioral sciences. Curr Opin Behav Sci 2018; 20: 40-46.






