CASOS CLÍNICOS
Endoftalmitis endógena bacteriana bilateral con asincronía de 14 meses por Klebsiella pneumoniae: reporte de un caso y revisión actualizada de la bibliografía
Pedro Javier Nuova
Ocularyb Oftalmoclínica y Servicio de Oftalmología del Sanatorio Modelo
Recibido: 24 de abril de 2023.
Aprobado: 15 de mayo de 2023
Autor corresponsal
Dr. Pedro Javier Nuova
Avenida Aconquija 267
(4107) Yerba Buena, provincia de Tucumán
Argentina
pedronuova@gmail.com
Oftalmol Clin Exp (ISSNe 1851-2658)
2023; 16(2): e164-e183.
Resumen
Objetivo: El propósito de este trabajo es describir un caso raro de endoftalmitis endógena bacteriana producida por Klebsiella pneumoniae en ambos ojos con una diferencia de inicio de los síntomas de 14 meses en un paciente inmunocompetente.
Caso clínico: Un hombre de 66 años inmunocompetente presentó una endoftalmitis endógena bilateral asincrónica producida por la bacteria Klebsiella pneumoniae a punto de partida de un absceso hepático posterior a una cirugía de colecistectomía, causando las endoftalmitis con un año y 2 meses de diferencia entre un ojo y otro. La primera en ojo izquierdo, que terminó en pérdida visual y ptisis bulbi por el retraso en el diagnóstico inicial y en el tratamiento instaurado, y la segunda en ojo derecho que conservó el órgano y una visión de 20/20 por la sospecha diagnóstica precoz y el rápido tratamiento instaurado.
Conclusiones: En nuestro conocimiento, este es el primer caso publicado de una endoftalmitis endógena bacteriana bilateral asincrónica producida por Klebsiella pneumoniae con una prolongada diferencia de un año y 2 meses en el comienzo de los síntomas entre un ojo y otro.
Palabras clave: endoftalmitis endógena bacteriana bilateral, Klebsiella pneumoniae, absceso hepático.
Bilateral endogenous bacterial endophthalmitis with asynchrony for 14 months due to Klebsiella pneumoniae: case report and updated review of the bibliography
Abstract
Purpose: Describe a rare case of bacterial endogenous endophthalmitis produced by Klebsiella pneumoniae in both eyes with a difference in onset of symptoms of 14 months in an immunocompetent patient.
Results: A 66 years old immunocompetent man presented asynchronous bilateral endogenous endophthalmitis produced by the Klebsiella pneumoniae bacterium at the starting point of a liver abscess after cholecystectomy surgery, causing the endophthalmitis one year and two months apart between an eye and another, the first in the left eye that ended in visual loss and pthisis bulbi due to the delay in the initial diagnosis and in the established treatment and the second in the right eye that preserved the organ and a vision of 20/20 due to the early suspected diagnosis and rapid instituted treatment.
Conclusions: To our knowledge, this is the first published case of asynchronous bilateral bacterial endogenous endophthalmitis caused by Klebsiella pneumoniae with a prolonged difference of 1 year and 2 months in the onset of symptoms between one eye and another.
Keywords: endophthalmitis endogenous bacterial bilateral, Klebsiella pneumoniae, liver abscess.
Endoftalmite bacteriana endógena bilateral com assincronia há 14 meses por Klebsiella pneumoniae: relato de caso e revisão atualizada da bibliografia
Objetivo: O objetivo deste trabalho é descrever um caso raro de endoftalmite bacteriana endógena causada por Klebsiella pneumoniae em ambos os olhos com diferença no início dos sintomas de 14 meses em um paciente imunocompetente.
Caso clínico: Um homem de 66 anos, imunocompetente, apresentou endoftalmite endógena bilateral assíncrona causada pela bactéria Klebsiella pneumoniae no ponto de partida de um abscesso hepático após cirurgia de colecistectomia, causando endoftalmite com um ano e dois meses de intervalo entre um olho e outro.
A primeira no olho esquerdo, que evoluiu com perda visual e phthisis bulbi devido à demora no diagnóstico inicial e no tratamento instituído, e a segunda no olho direito que preservou o órgão e visão 20/20 devido à suspeita diagnóstica e tratamento rápido instituído
Conclusões: Até onde sabemos, este é o primeiro caso publicado de endoftalmite bacteriana endógena bilateral assíncrona causada por Klebsiella pneumoniae com uma diferença prolongada de um ano e dois meses no início dos sintomas entre um olho e outro.
Palavras-chave: endoftalmite bacteriana endógena bilateral, Klebsiella pneumoniae, abscesso hepático.
Introducción
La endoftalmitis se define como la inflamación de los espacios internos intraoculares que en la práctica clínica generalmente se entiende como una inflamación secundaria a infección intraocular1. Se la clasifica según la vía de infección en: exógena, cuando los agentes infecciosos proceden del exterior como ocurre tras cirugía ocular, herida penetrante en el ojo, úlcera corneal o infección periocular; y en endógena, cuando el microorganismo alcanza el ojo tras bacteriemia secundaria a un foco primario extraocular1.
La endoftalmitis endógena (EE) se clasifica, a su vez, en focal o difusa según el grado de afectación: anterior o posterior según la localización; y panoftalmía si además están afectados esclera y órbita. Es una patología poco frecuente con un pobre pronóstico visual que requiere de un diagnóstico y de tratamiento precoz. Es una causa potencial de ceguera, resultado de la extensión hematógena de un germen desde un foco primario extraocular. Su incidencia es baja, 2%-8% de todos los casos de endoftalmitis, pero puede incrementarse en personas con patologías crónicas, inmunodeprimidos y en sometidos a procedimientos y técnicas invasivas2.
Se han relacionado algunos factores predisponentes entre los que destaca la diabetes mellitus, el uso prolongado de antibióticos y de esteroides o inmunosupresores sistémicos, nutrición parenteral, procedimientos invasivos previos, cirugías abdominales previas, procedimientos génito-urinarios y dentales, hospitalización prolongada, neoplasias, SIDA, abuso de drogas endovenosas o trasplantes de órganos6.
Los gérmenes causales varían dependiendo del área geográfica. Entre ellos tenemos hongos (Candida sp., la más representativa), bacterias Gram-positivas (Staphylococcus aureus y Streptococcus sp.) y Gram-negativas (Klebsiella pneumoniae, Neisseria meningitidis, Enterobacteriaceae sp. y Pseudomona aeruginosa)17.
Los hongos son los gérmenes más frecuentemente implicados, principalmente la Candida albicans y el Aspergillus (este último, con una evolución especialmente mala)8. Las infecciones fúngicas se observan con mayor frecuencia en sujetos con trasplantes de órganos sólidos y uso de medicamentos intravenosos9. El abuso de drogas intravenosas, el ingreso a la unidad de cuidados intensivos, la presencia de catéteres venosos centrales, la terapia con antibióticos de amplio espectro, la nutrición parenteral y la cirugía abdominal representan factores de riesgo para la candidemia y, por lo tanto, la endoftalmitis por Candida10.
En las endoftalmitis endógenas bacterianas (EEB) en general habría una mayor proporción de bacterias Gram-negativas y Gram-positivas más agresivas (Streptococcus y Staphylococcus aureus), mientras que el Staphylococcus epidermidis rara vez es el germen causante de EEB. Entre las bacterias Gram-positivas más frecuentes nos encontramos con el Staphylococcus aureus, los Streptococcus del grupo B, el Streptococcus pneumoniae y la Listeria monocytogenes. Entre los gérmenes Gram-negativos cabe destacar la Klebsiella sp., la Escherichia coli, la Pseudomona aeruginosa y la Neisseria meningitidis. En general presentan más posibilidades de mantener visión útil las infecciones por Gram-positivos que por Gram-negativos11-13. Los gérmenes Gram-negativos son más frecuentes en la población asiática14-15, mientras que los Gram-positivos son más frecuentes en la población occidental16-18.
El propósito de este trabajo fue describir un raro caso de endoftalmitis endógena bacteriana producida por Klebsiella pneumoniae en ambos ojos con una diferencia de inicio de los síntomas de 14 meses en un paciente inmunocompetente, su seguimiento en el largo plazo y una revisión extensa del tema.
Caso clínico
Se presentó a consulta un paciente de sexo masculino que tenía 66 años de edad en el momento de la primera consulta; de profesión trabajador rural, asistió por dolor ocular izquierdo y pérdida de visión de 1 mes de evolución.
Como antecedentes oculares de importancia el paciente refirió una pérdida de visión aguda y dolorosa en su ojo izquierdo 30 días antes aproximadamente. Consultó en su pueblo de montaña, a 200 km de nuestra ciudad, en una sala sanitaria que lo derivó al oftalmólogo más cercano a 40 km. Éste le recetó colirios antibióticos comerciales cada 3 horas sin un diagnóstico preciso y sin referir mejoría con el tratamiento tópico instaurado.
Como antecedentes personales de importancia sólo refirió una cirugía de extracción de vesícula biliar (colecistectomía) dos meses antes del comienzo del cuadro ocular. No refirió antecedentes de diabetes mellitus.
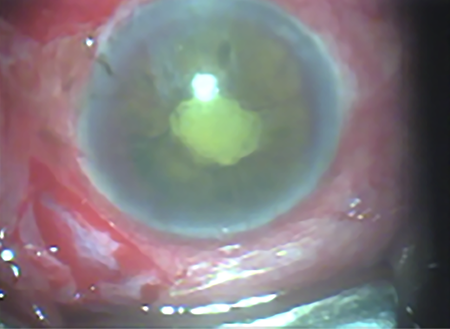
El examen oftalmológico inicial constató una agudeza visual (AV) de 20/40 sin corrección y 20/20 con corrección en ojo derecho y luz con regular proyección en ojo izquierdo. Al examen externo se observó una inflamación palpebral superior e inferior izquierda sin restricción de la motilidad ocular. El examen biomicroscópico del ojo derecho era normal (cristalino transparente, presión ocular 12 mmHg y fondo de ojos normal). El examen oftalmológico de ojo izquierdo reveló secreción purulenta conjuntival, hiperemia y edema conjuntival, rubeosis de iris, sinequias posteriores, catarata, presión ocular muy baja de 2 mmHg y vitreítis severa, que no permitía la observación de la retina (fig. 1).

Figura 1. Biomicroscopía de ojo izquierdo.
Se realizó una ecografía ocular izquierda que informó unas imágenes puntiformes hiperecogénicas múltiples y membranas móviles que llenaban la cavidad vítrea compatibles con vitreítis severa. La retina impresionaba aplicada (fig. 2).
Se diagnosticó endoftalmitis y se decidió realizar una vitrectomía por pars plana de urgencia en donde se constató una perforación ocular pequeña en hora 6 por donde drenaba material purulento al exterior; se hizo una lensectomía, se realizó extracción de muestra vítrea para examen directo y cultivo y se terminó con una inyección intravítrea de antibióticos de amplio espectro: vancomicina (1 mg en 0,1 ml) y ceftazidima (2,25 mg en 0,1 ml) (fig. 3).
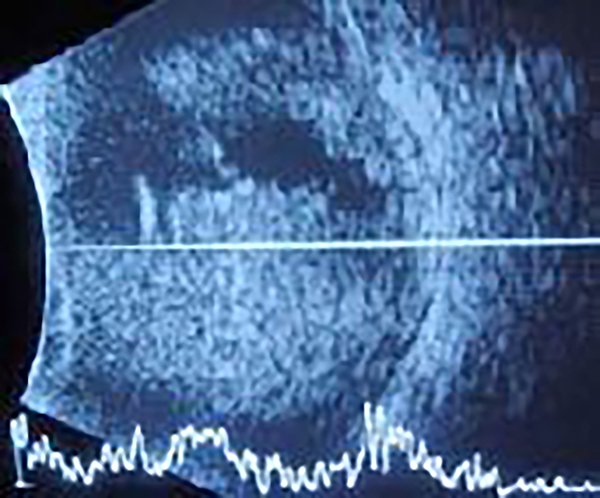
Figura 2. Ecografía de ojo izquierdo.

Figura 3. Vitrectomía de ojo izquierdo.
Se sospechó un trauma ocular penetrante por el orificio ocular inferior a pesar de ser negado repetidamente por el paciente y por su profesión de trabajador rural. Se indicó antibióticos por vía oral (ciprofloxacina 500 mg cada 12 horas) y colirios fortificados de vancomicina y ceftazidima alternados cada 30 minutos en espera de resultados del examen directo y cultivo, y colirio de atropina 1% cada 12 horas.
El examen directo informó la presencia de bacterias Gram (-). A las 72 horas el cultivo informó Klebsiella pneumoniae sensible a ciprofloxacina, ceftazidima e imipenem, por lo que se siguió con el esquema indicado anteriormente (fig. 4).

Figura 4. Cultivo de humor vítreo izquierdo.
El ojo evolucionó sin dolor y sin visión, con presión ocular de 2 mmHg.
Debido a la naturaleza del germen se cambió la sospecha diagnóstica de un trauma ocular a un origen endógeno, por lo que se derivó al paciente a clínica general e infectología. La perforación ocular se interpretó como un sitio de drenaje espontáneo del contenido purulento producido desde el interior debido al absceso vítreo de 1 mes de evolución.
Pero como el paciente ya no sentía dolor, decidió realizar las consultas clínicas en su lugar de origen y desapareció por un tiempo.
Regresó a los 6 meses para control, diciendo que su médico clínico lo había seguido medicando con antibióticos orales durante un tiempo, sin mayores precisiones, e indicaba que no sentía dolor en el ojo ni en ninguna parte del cuerpo. El examen oftalmológico del ojo izquierdo revelaba una ptisis bulbi, sin visión y presión ocular de 0 mmHg.
Regresó a nuestro servicio 8 meses después de este control, es decir, 1 año y 2 meses después de la primera consulta, por una repentina y dolorosa pérdida de visión en el otro ojo —el derecho— de 1 día de evolución. Esta vez decidió venir directamente a nuestro servicio en la ciudad sin consultar en su lugar de origen. Como antecedente nuevo refirió haber estado internado en un hospital zonal por problemas abdominales y haber recibido antibióticos sistémicos endovenosos sin precisar el nombre de ellos.
Al examen oftalmológico se constató en su ojo derecho una disminución severa de AV a cuenta dedos a 1,5 metros que no mejoraba con agujero estenopeico; a la biomicroscopía se observó edema e hiperemia conjuntival, reacción fibrinoide en cámara anterior e hipopión de 1,5 mm (fig. 5), la presión ocular era de 10 mmHg y el examen de fondo de ojo era dificultoso por falta de dilatación pupilar adecuada por sinequias posteriores, pero impresionaba una vitreítis de 2 a 3 cruces con retina aplicada (fig. 6). El ojo izquierdo presentaba la ptisis bulbi anteriormente descrita y el paciente usaba una cascarilla cosmética (fig. 7).
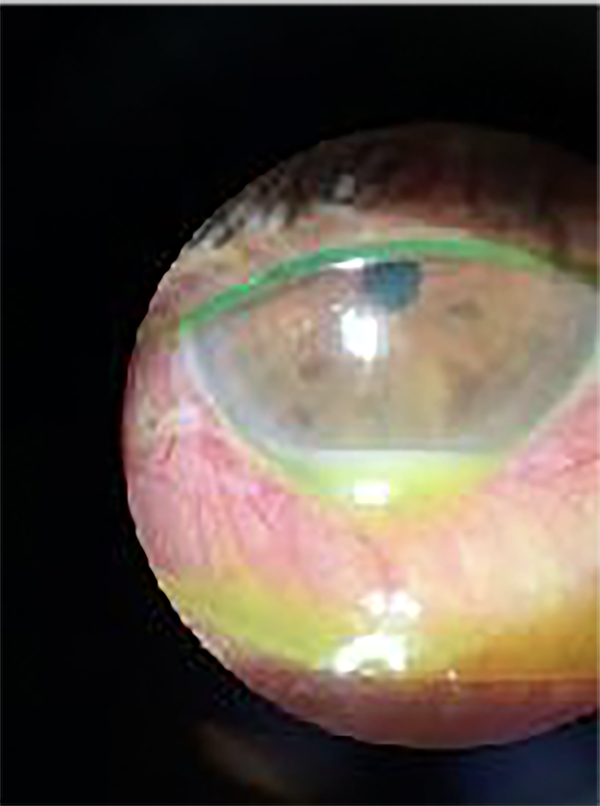
Figura 5. Biomicroscopía de ojo derecho.
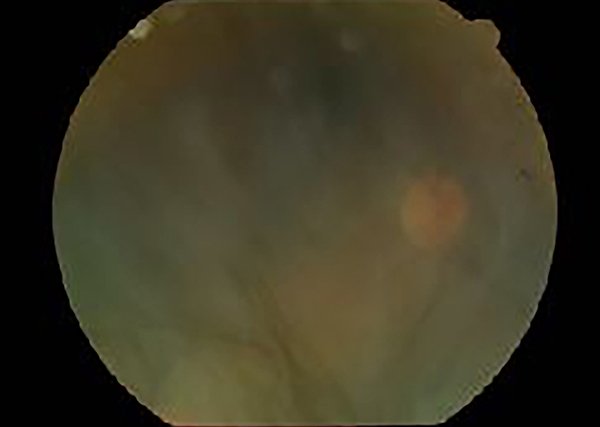
Figura 6. Retinografía de ojo derecho.
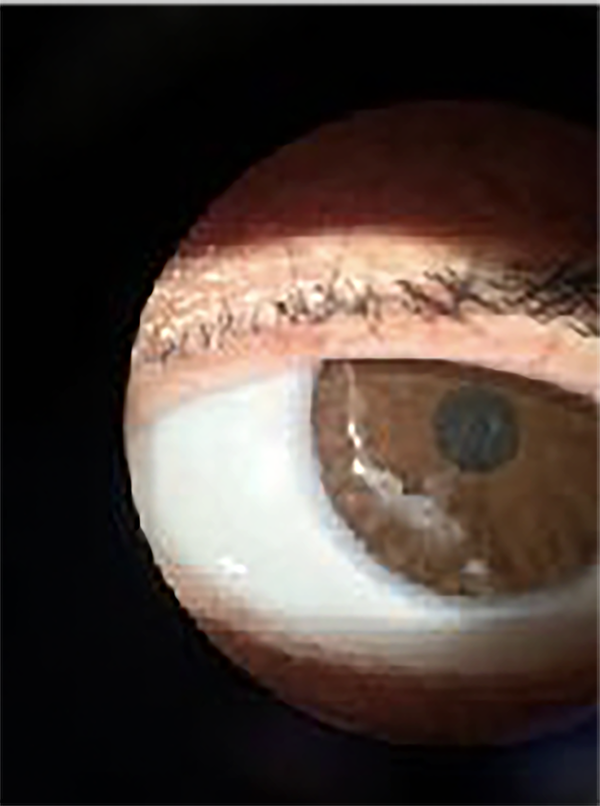
Figura 7. Biomicroscopía de ojo izquierdo (Prótesis ocular).
Ante la urgencia del cuadro se decidió realizar una punción vítrea inmediata con toma de muestra e inyección intravítrea de vancomicina y ceftazidima a dosis habituales. Se indicó colirios fortificados de vancomicina y ceftazidima alternados cada 30 minutos, atropina 1% una gota cada 12 horas y ciprofloxacina vía oral 1 comprimido de 500 mg cada 12 horas. Se indicó interconsulta urgente con infectología —que decidió la internación del paciente para profundizar los estudios—, se tomó muestra para hemocultivo y se inició tratamiento antibiótico con imipenem endovenoso a dosis habitual (500 mg cada 6 horas).
Se realizó una ecografía ocular 12 horas después de la punción vítrea en la que se observó una vitreítis moderada y un desprendimiento coroideo periférico (fig. 8).

Figura 8. Ecografía de ojo derecho.
La evolución ocular fue lentamente favorable, mejorando la agudeza visual a 20/80 los primeros días, con desaparición del hipopión, presión ocular de 4 mmHg y mejoría de la vitreítis.
Los exámenes de laboratorio fueron normales, excepto la eritrosedimentación elevada (30 mm/hora), la proteína C reactiva elevada (48 mg/l) y en el hepatograma se observaba una fosfatasa alcalina elevada (141 U/L para valores normales de 40 a 130 U/L) y una gamma GT elevada (84 U/L para valores normales de 8 a 37 U/L). La prueba de ELISA para el virus de inmunodeficiencia humana (VIH) fue negativa. El resultado del cultivo vítreo fue negativo, pero el resultado del hemocultivo informó K. pneumoniae (el mismo germen responsable de la endoftalmitis del otro ojo el año anterior).
Se realizó una ecografía abdominal que informó en hígado una imagen hipoecogénica irregular de 37 x 37 mm en lóbulo derecho, vía biliar no dilatada, vesícula biliar ausente y el resto de los órganos abdominales sin particularidades (fig. 9).
Para confirmar estos hallazgos se realizó una tomografía computada de abdomen y pelvis que informó un hígado aumentado de tamaño por lesión hipodensa en lóbulo derecho con refuerzo periférico luego de la administración endovenosa de sustancia de contraste (fig. 10).
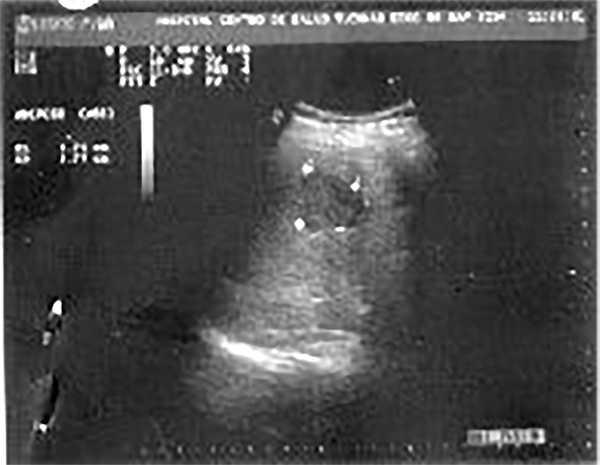
Figura 9. Ecografía hepática.
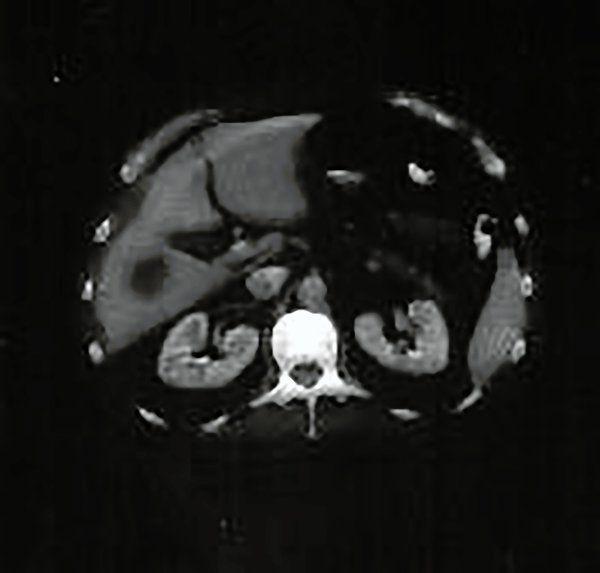
Figura 10. Tomografía computada abdominal.
También se realizó endoscopía digestiva alta y baja sin particularidades.
Con todos estos hallazgos se hizo el diagnóstico de absceso hepático crónico y se realizó un drenaje quirúrgico percutáneo guiado por imágenes. La evolución general fue buena, sin complicaciones, y la evolución ocular fue lentamente favorable disminuyéndose progresivamente los antibióticos por las distintas vías de administración.
Al mes la agudeza visual mejor corregida en ojo derecho era de 20/40; a la biomicroscopía la cámara anterior estaba limpia y sólo se observaban algunas sinequias posteriores inferiores entre iris y cristalino (fig. 11), la presión intraocular era de 10 mmHg, el fondo de ojos tenía una leve vitreítis y se observaba la retina normal (fig. 12).
La ecografía ocular mostraba una retina aplicada, sin desprendimientos coroideos y un vítreo limpio con algunos flotadores aislados (fig. 13).
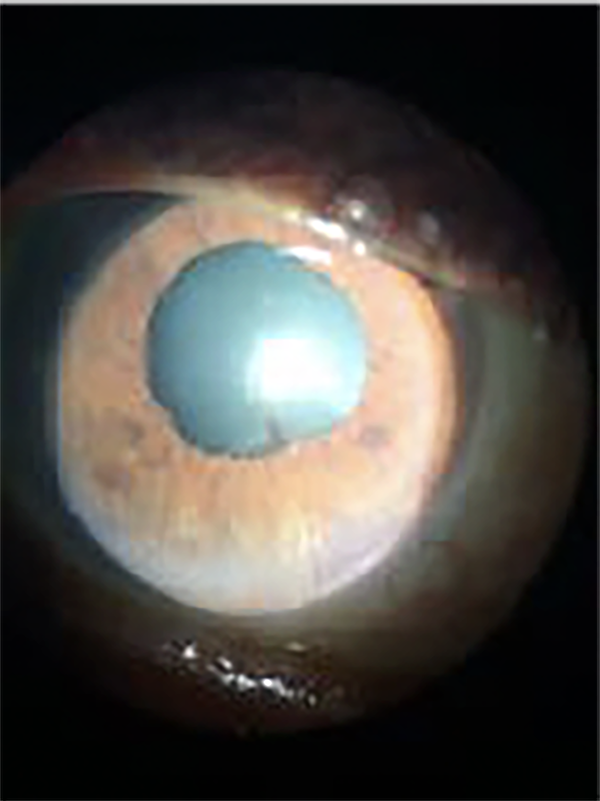
Figura 11. Biomicroscopía de ojo derecho.

Figura 12. Retinografía de ojo derecho.
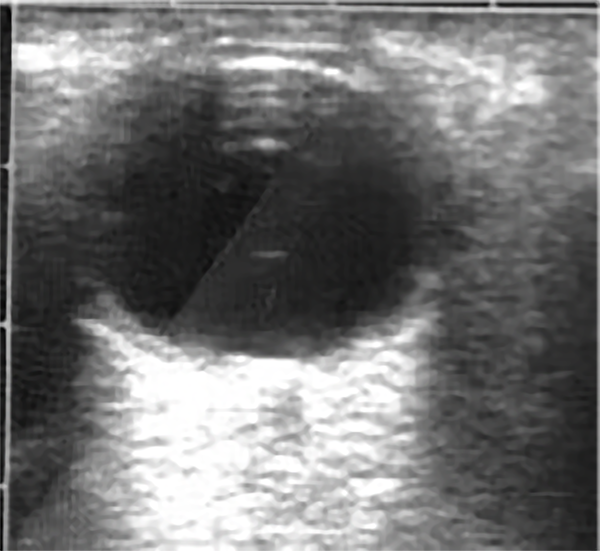
Figura 13. Ecografía de ojo derecho.
A los 6 meses la agudeza visual mejor corregida había mejorado a 20/25, la presión ocular era de 17 mmHg y la retina y vítreo estaban normales.
Los episodios infecciosos oculares e internaciones por causas abdominales previas no se repitieron más.
Luego de 5 años el paciente se presentó nuevamente a consulta en el servicio por disminución visual progresiva y no dolorosa en su ojo derecho (su único ojo funcional) a 20/200, sin mejoría con estenopeico. En el examen biomicroscópico se observó una catarata nuclear grado 3 de la clasificación LOCS III con pobre dilatación pupilar por las sinequias posteriores. La presión ocular era de 18 mmHg y el fondo de ojos estaba normal. Entonces se realizó una facoemulsificación sin complicaciones, con anestesia tópica, incisión corneal, sinequiolisis, dilatación pupilar con anillo de Malyugin, extracción de la catarata con técnica de stop and chop e inserción de lente intraocular plegable de acrílico hidrofóbico de 23,50 D. La evolución postoperatoria fue excelente obteniendo una AV de 20/20 con una refracción de +0,75 esf y -1,00 cil x 100 grados.
Luego de 2 años de la cirugía de catarata el paciente persistía con una AV mejor corregida de 20/20 en su ojo derecho, con una lente intraocular transparente y centrada en la biomicroscopía (fig. 14), con una dilatación pupilar intermedia y una leve atrofia zonal de iris en sector temporal inferior (fig. 15), una presión ocular de 12 mmHg y un fondo de ojos con retina aplicada, vítreo limpio y una atrofia coriorretinal en periferia nasal inferior con dispersión pigmentaria alrededor de la atrofia (fig. 16).
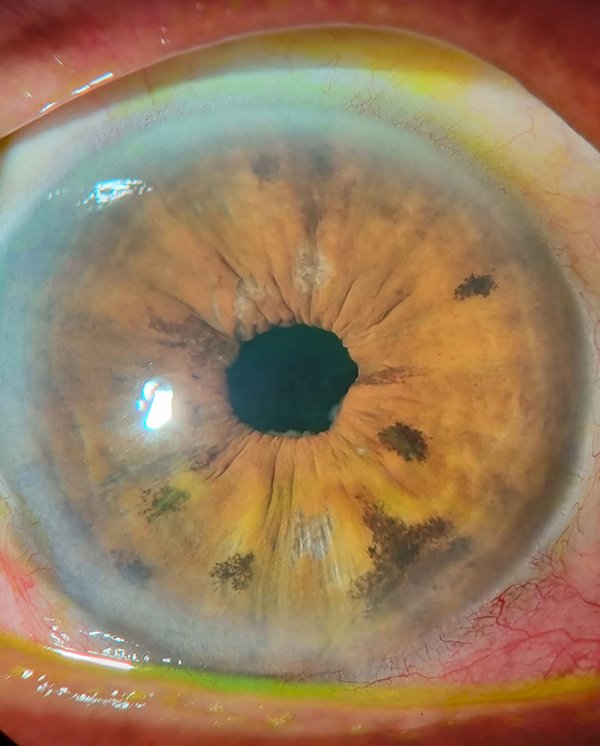
Figura 14. Biomicroscopía de ojo derecho (sin dilatación pupilar).
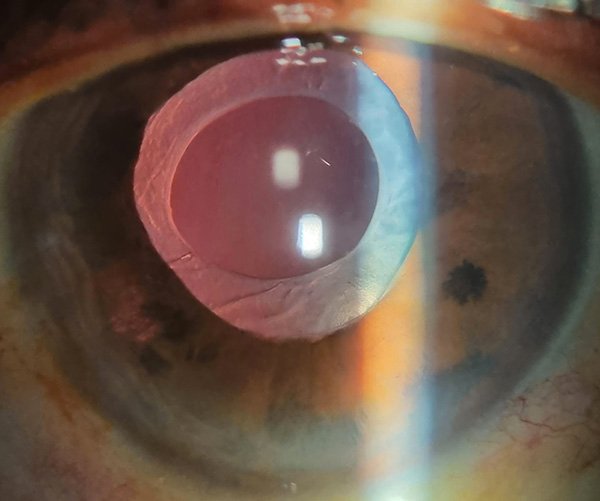
Figura 15. Biomicroscopía de ojo derecho (con dilatación pupilar).
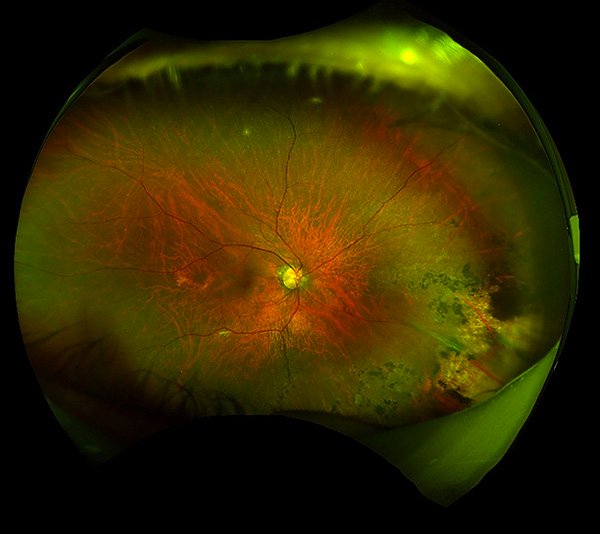
Figura 16. Retinografía de campo amplio de ojo derecho.
Discusión
La K. pneumoniae es el patógeno más comúnmente reportado de EEB en todo el mundo1, 14. Es más frecuente en Asia, pero su incidencia en el resto del mundo va en aumento. La diabetes y la enfermedad hepatobiliar son factores predisponentes importantes y el absceso hepático es la principal fuente de infección por su entrada a través de la circulación portal, como en el caso de nuestro paciente1, 19-24. Varios trabajos publicaron una mortalidad de entre el 5% y el 21%16, 20-21. Los pacientes con absceso hepático por Klebsiella tienen un riesgo del 3% de desarrollar EEB25, aunque en los países donde el absceso hepático por K. pneumoniae es frecuente (Taiwán), la incidencia de asociación con endoftalmitis llega a superar el 10%26. Esto se relaciona con las características propias del germen, que incluyen el serotipo K1, resistente a la fagocitosis y la presencia del gen mag-A que favorecen la aparición de una cepa hipervirulenta con capacidad de colonizar, crecer y sobrevivir luego de la entrada en el torrente sanguíneo27-29.
En una revisión de Kashani y Eliott publicada en 2013 se determinaron los siguientes hallazgos: las EEB son raras (2%-8%), pero de muy pobre pronóstico visual (el 90% sólo alcanza visión luz o peor); son bilaterales en un 14% a 25%; la diabetes mellitus es el factor de riesgo más común (68%); los gérmenes Gram-negativos tienen peor pronóstico; los abscesos piógenos hepáticos son causados por Gram-negativos y producen una bacteriemia transitoria y sintomatología intermitente; y la mortalidad bajó de 90% a menos de 10% con el diagnóstico precoz y el tratamiento oportuno19.
Los principales focos extraoculares serían el tracto gastro-intestinal, el tracto urinario, la endocarditis, la meningitis, la neumonía, la infección de piel y las partes blandas, y los catéteres intravasculares. El absceso hepático, como el caso de nuestro paciente, se ha implicado como foco primario de EEB principalmente en el continente asiático20, 26, 30-32, aunque nuestro paciente no presenta antepasados asiáticos ni vivió en ese continente, por el contrario es descendiente de indígenas latinoamericanos.
Según el trabajo de revisión de 20 años de Chen, la mayoría de los abscesos hepáticos fueron únicos (74%), localizados en el lóbulo derecho (60,6%) y con un diámetro máximo de 5,6 cm, lo que coincide con los hallazgos ecográficos de nuestro paciente26.
Binder y colaboradores, en una serie de 27 pacientes, no encontraron un foco extraocular hasta en un 44% de los casos, por lo que defienden que una bacteriemia transitoria podría ser la causa de endoftalmitis3. Esta bacteriemia transitoria podría ser la causa más probable de la EEB bilateral asincrónica de nuestro paciente. Sin embargo, sólo un 33,3% tenía hemocultivos positivos y la mayoría (70,5%) se diagnosticó a través de cultivos de muestras de humor vítreo o acuoso. Esto contrasta con otras series en las que los hemocultivos ayudaron al diagnóstico en un mayor porcentaje de casos (60%-95%), donde el rendimiento de las muestras intraoculares eran más bajos (37%-56%)1, 13, 15, 20, 26. También se han de cultivar todos los focos posibles de infección incluyendo catéteres y heridas supurantes (61% al 70% de positividad). El porcentaje de positividad aumentó con la introducción de la reacción en cadena de la polimerasa (PCR) para genoma eubacteriano y panfúngico. Dado que no existe una diferencia estadísticamente significativa en los resultados de la PCR realizada en humor acuoso y líquido vítreo, la PCR en humor acuoso podría ser el método de elección considerando la seguridad y la simplicidad de su recolección33.
En nuestro paciente el cultivo vítreo del primer ojo (el izquierdo) dio resultado positivo para K. pneumoniae, pero no se realizó hemocultivo porque no se sospechaba una EE, mientras que al presentarse un cuadro similar en el ojo derecho más de un año después sí se realizaron ambos cultivos, donde fue positivo para K. pneumoniae el hemocultivo y negativo el cultivo vítreo.
Connell y colaboradores hallaron que, de 64 muestras oculares recogidas, 41 fueron positivas (64,1%). De ellas, el 65,9% correspondió a hongos; 19,5% a bacterias Gram-negativas y 14,6% a bacterias Gram-positivas34. La particularidad de nuestro caso es que podría incluirse en el 64,1% de positividad para el ojo izquierdo y en el 35,9% de negatividad para el ojo derecho.
Las manifestaciones oculares van a depender de la localización. Es unilateral en el 80% de los casos aproximadamente y puede aparecer disminución brusca de la visión, dolor y miodesopsias. Entre los signos podemos encontrar hiperemia cilio-conjuntival, edema corneal, celularidad en cámara anterior, hipopión, celularidad vítrea anterior y vitreítis de moderada a intensa. En el fondo de ojo pueden observarse lesiones coriorretinales focales, infiltrados perivasculares, necrosis, hemorragias y émbolos arteriales. El daño retinal es causado en parte por toxinas microbianas y exacerbado por la isquemia causada por émbolos sépticos. Además de una marcada participación de los segmentos anterior y posterior del ojo, los tejidos orbitarios también pueden verse afectados. Puede haber edema palpebral severo, quemosis y proptosis, con limitación de los movimientos oculares. Nuestro paciente presentó un cuadro florido de endoftalmitis difusa ántero-posterior en ojo izquierdo debido a la demora en el diagnóstico inicial, mientras que presentó un cuadro inicial de endoftalmitis focal en ojo derecho que, debido a la alta sospecha diagnóstica por su antecedente del ojo contralateral, fue tratado adecuadamente en tiempo y forma.
Algunos estudios han probado una mayor afectación del ojo derecho con respecto del izquierdo35. El ojo derecho se afectaría con el doble de frecuencia que el izquierdo, probablemente debido al flujo sanguíneo más proximo y directo a la arteria carótida derecha2. Pero nuestro caso parecería refutar esta teoría porque el primer ojo afectado fue el izquierdo y coincide con la revisiones de Chen y Chung que encontraron una afección en el ojo izquierdo en el 54,2% y 60,5% de los casos respectivamente20, 26.
Jackson y colaboradores encontraron sólo 12% de bilateralidad en las EE1, mientras que en una revisión de 20 años de Chen y colaboradores la bilateralidad fue del 15,4%26 y en otras revisiones de Hong Kong fue más alta aún (26,3% y 28,6%)20-21. Por lo tanto podríamos decir que la bilateralidad, como el caso de nuestro paciente, se produce en una minoría de casos y varía entre 12% y 28,6% en la bibliografía.
En un estudio de Park y colaboradores, los síntomas oculares se desarrollaron antes del diagnóstico de abscesos hepáticos en el 66,7% de los casos, como en nuestro paciente36. Estos hallazgos fueron confirmados por otros reportes de casos37-38.
Solo el 57% de los pacientes con EEB presenta síntomas sistémicos. Aparece cefalea, malestar general, náuseas, pérdida del apetito o de peso y dolor abdominal1. Nuestro paciente no mostraba síntomas sistémicos en el momento del diagnóstico de ambas endoftalmitis, pero sí tenía antecedentes de cirugía de colecistectomía e internaciones por complicaciones abdominales.
La AV puede variar de 10/10 a no percepción de luz, dependiendo de la localización y de la gravedad de la afectación. En nuestro caso las AV de presentación fueron muy pobres (regular proyección luminosa en ojo izquierdo y cuenta dedos a 1,5 metros en ojo derecho).
El diagnóstico lo hace el oftalmólogo basado en las manifestaciones clínicas oculares de un paciente con factores de riesgo. Sin embargo, es importante la toma de muestra tanto ocular (humor acuoso y vítreo) como sistémica (sangre, heridas supurantes, catéteres, otras) antes de iniciar la terapia antibiótica para conocer el germen causal, dirigir el tratamiento posterior y demostrar la presencia de bacteriemia (hemocultivos positivos).
Además de las pruebas de laboratorio de diagnóstico iniciales se deben considerar pruebas para la infección por VIH en personas sanas con endoftalmitis39.
El inicio del tratamiento con antibioticoterapia sistémica es crucial en el manejo de la EEB, pues permite actuar sobre el ojo y sobre el posible foco primario de la infección. En la endoftalmitis la barrera ocular se encuentra afectada, lo que permite una concentración de antibióticos a niveles terapéuticos en el ojo. Los antibióticos sistémicos también tratan focos distantes de infección y previenen la bacteriemia continua, por lo que reducen las posibilidades de invasión del ojo no afectado. Los antibióticos se eligen inicialmente de forma empírica teniendo en cuenta el lugar de adquisición de la bacteriemia, las enfermedades subyacentes y el foco de origen. La elección posterior del antibiótico responderá a los resultados de los cultivos con antibiograma.
Se ha demostrado en la actualidad que las fluoroquinolonas de cuarta generación (gatifloxacina, moxifloxacina) y dentro de las oxazolidinonas el linezolide —por vía oral o parenteral— alcanzan concentraciones potencialmente terapéuticas en el vítreo40. Chung y colaboradores declararon que la ceftriaxona endovenosa se recomendaba en el tratamiento de la endoftalmitis por Klebsiella, ya que tenía una buena penetración en el líquido cefalorraquídeo y el vítreo20.
En el caso particular de la EEB causada por un absceso hepático se ha demostrado que los gérmenes son multirresistentes y los antibiogramas demostraron que los carbapenem, como imipenem y meropenem, tenían los mayores efectos antibióticos y antiinflamatorios en estos casos particulares41. Teniendo en cuenta este trabajo y el resultado del antibiograma en nuestro paciente, se decidió iniciar el tratamiento sistémico con imipenem endovenoso.
Sin embargo, hay controversia en cuanto al uso y momento de la antibioticoterapia intravítrea. Greenwald y colaboradores clasificaron las endoftalmitis según el grado de afectación en: focal, anterior difusa, posterior difusa y panoftalmitis, considerando que la focal y anterior difusa podrían tratarse con antibioticoterapia sistémica exclusivamente2. Otros autores proponen la antibioticoterapia intravítrea junto con biopsia como medida obligada para alcanzar un diagnóstico rápido y conseguir niveles terapéuticos de antibióticos intraoculares1, 13. Sin embargo, la falta de estudios prospectivos randomizados hace que cada caso deba ser individualizado.
Según el Endophthalmitis Vitrectomy Study (EVS), las bacterias Gram-positivas, incluido el Staphylococcus aureus resistente a la meticilina, son susceptibles a la vancomicina (1 mg/0,1 mL). Los microbios Gram-negativos son sensibles a la ceftazidima (2,25 mg/0,1 mL), que no muestra la gran toxicidad retinal de los aminoglucósidos. Estos son los recomendados actualmente como terapia empírica de inicio42.
Algunos autores demostraron que la dexametasona intravítrea redujo el requerimiento de enucleación o evisceración (p = 0,01)1, 8, mientras que otras publicaciones no revelaron mejores resultados visuales de los casos con administración adicional de corticosteroides43-45.
Con respecto de la vitrectomía, aunque indicada en los casos de endoftalmitis exógenas, debe ser tomada con reservas en las formas de EEB46. Las recomendaciones del EVS pueden no aplicarse debido, entre otras razones, a que el espectro de los microorganismos causantes difiere significativamente en la EE. Aunque en los casos más leves de la infección los antibióticos sistémicos e intravítreos pueden ser suficientes, en los casos graves de endoftalmitis la vitrectomía puede resultar beneficiosa porque elimina los microrganismos participantes, el medio inflamatorio y las sustancias tóxicas presentes en la cavidad vítrea. Las ventajas teóricas de la vitrectomía incluyen la eliminación de los organismos infecciosos, las endotoxinas, las exotoxinas y las membranas vítreas que podrían conducir al desprendimiento de retina, la limpieza de las opacidades vítreas, la recolección de abundante material para cultivo y posiblemente una mejor distribución de antibióticos intravítreos20. Puede triplicar la posibilidad de mantener una visión útil y reducir por tres la probabilidad de enucleación o evisceración8. Actualmente se preconiza la vitrectomía temprana, ya que las posibilidades de complicaciones son mínimas en comparación con los buenos resultados obtenidos. Las desventajas de la vitrectomía incluyen el riesgo de complicaciones anestésicas y quirúrgicas, así como el efecto cataratogénico o el desprendimiento de retina secundario47.
Por todo lo antedicho, ante la sospecha de endoftalmitis avanzada en el primer ojo (izquierdo) decidimos realizar una vitrectomía, tomar muestra e inyectar vancomicina y ceftazidima como antibióticos empíricos, e iniciar ciprofloxacina vía oral. Ante la aparición posterior de un cuadro similar pero menos avanzado en ojo derecho decidimos realizar una punción vítrea con toma de muestra e inyección de los mismos antibióticos empíricos: indicamos nuevamente ciprofloxacina vía oral y derivamos urgente a infectología que inició tratamiento con imipenem endovenoso teniendo en cuenta los resultados del cultivo vítreo del ojo izquierdo del año anterior hasta obtener los resultados del hemocultivo actual que arrojó como resultado el mismo germen y la misma susceptibilidad, por lo que se continuó el tratamiento con imipenem endovenoso hasta la resolución quirúrgica del absceso hepático.
Modjtahedi y colaboradores compararon casos de EE con vitrectomía inicial (12 de 68 ojos) con aquellos que se sometieron a punción inicial e inyección (53 de 68 ojos); no hubo diferencias significativas en el resultado visual entre los dos grupos; sin embargo, aquellos que se sometieron a una punción inicial e inyección tenían más probabilidades de requerir una vitrectomía secundaria48. Además, la vitrectomía primaria no siempre fue posible debido al mal estado físico de algunos sujetos en el momento del diagnóstico49. Chen no informó diferencias en los resultados de agudeza visual entre los ojos con o sin vitrectomía temprana26. Sin embargo, Yoon y colaboradores afirmaron que 6 meses después de la vitrectomía temprana para la EEB por K. pneumoniae, en el 50% de los ojos la visión era de cuenta dedos o mejor50. Los mismos resultados obtuvieron Lee y colaboradores publicando que la vitrectomía realizada dentro de los 10 días posteriores a la aparición de síntomas oculares resultó en un mejor pronóstico visual que sin vitrectomía51.
Wang y colaboradores concluyeron que la vitrectomía combinada con inyección intravítrea de antibióticos fue eficaz en el tratamiento de la EEB. Pero además, el tratamiento activo de las lesiones primarias fue fundamental; por lo tanto, la administración de antibióticos sistémicos debe acompañarse de un tratamiento activo de drenaje quirúrgico del absceso hepático41. Esto fue demostrado involuntariamente en nuestro caso, ya que el primer ojo fue tratado localmente con vitrectomía y antibióticos intravítreos, pero el paciente no recibió tratamiento sistémico endovenoso porque decidió volver a su lugar de origen sin tratarse adecuadamente, y el cuadro de EEB se repitió en el otro ojo 1 año y 2 meses después, realizando nuevamente terapia local con inyección de antibióticos intravítreos y ahora sí terapia sistémica con antibióticos endovenosos y drenaje quirúrgico del absceso hepático. Recién entonces se obtuvo la curación de la enfermedad sin que se repitieran estos cuadros infecciosos hasta la actualidad, luego de un seguimiento de 7 años.
Los estudios que investigaron los factores pronósticos en EEB fueron retrospectivos y, aunque no se puede excluir el sesgo de selección, identificaron varios factores que afectan adversamente el pronóstico. Estos incluyeron agudeza visual inicial peor a cuenta dedos, dolor ocular, presentación inicial con síntomas oculares sin síntomas o signos sistémicos, hipopión, edema corneal, hipertensión ocular, infección difusa del vítreo y la retina, absceso subretinal, panoftalmitis, ausencia de visión del fondo de ojos, retraso en el diagnóstico, cultivos de fluidos intraoculares positivos, uso de antibióticos inapropiados, infección con organismos virulentos e infección por Gram-negativos (Klebsiella sp., E. coli, Serratia sp., etc.)2, 13-14, 20-21, 26, 52. Mientras que los factores asociados con mejor pronóstico visual fueron: agudeza visual inicial mejor que cuenta dedos, vitrectomía por pars plana, EE de tipo focal e inyección intravítrea dentro de las primeras 24 horas después del diagnóstico53.
Nuestro paciente presentaba varios factores de mal pronóstico, pero la diferencia fundamental en el resultado final entre un ojo y otro fue el retraso en el diagnóstico adecuado en el primer ojo y, por lo tanto, la demora en iniciar una terapia correcta.
El pronóstico visual suele ser desfavorable con porcentajes de 32% de visión útil, 44% de ceguera, 25% de enucleaciones o evisceraciones y una tasa de mortalidad asociada apreciable de un 5% hasta un 14%8, 21, 26, 41. Un trabajo de Chung y colaboradores en Hong Kong publicó un 60% de evisceraciones y un 20% de ojos con no percepción luminosa20. En un estudio de Ang y colaboradores, en 71 ojos de 61 pacientes con EEB por K. pneumoniae se encontró una pérdida visual severa en el 76% de los casos, a pesar del tratamiento adecuado con una alta probabilidad de ceguera bilateral54. Nuestro paciente presentó un resultado desfavorable en su ojo izquierdo con pérdida de la visión y ptisis y un resultado excelente en ojo derecho con agudeza visual de 20/20 siete años después del cuadro inicial.
Se publicaron varios casos unilaterales de EEB en la bibliografía. Entre ellos podemos destacar dos de EEB unilaterales por K. pneumoniae en pacientes inmunocompetentes con absceso hepático que tuvieron un mal resultado visual a pesar del tratamiento antibiótico local y sistémico39 y un trabajo malayo reciente que publicó 3 casos de EEB unilaterales por K. pneumoniae55: el primero fue de una mujer de 34 años con neumonía y EEB en ojo derecho que terminó en evisceración a pesar del tratamiento con antibióticos sistémicos y tópicos y una vitrectomía con inyección de antibióticos intravítreos. El segundo caso fue una mujer de 38 años con panoftalmitis del ojo derecho secundaria a un absceso renal izquierdo complicada con un absceso de los ganglios basales, que respondió a dosis alta de antibióticos intravítreos y endovenosos, pero desafortunadamente el ojo derecho fue a la ptisis. El caso 3 fue una mujer de 70 años con EEB de ojo derecho y antecedentes de un adenocarcinoma de colon y neumonía que fue tratada con 2 punciones vítreas para toma de muestra e inyección de antibióticos. Desafortunadamente el ojo se volvió tísico.
La EE bilateral suele ser más frecuente en series con predominio de agentes etiológicos fúngicos. Existen algunos casos reportados de EE bilaterales por cándidas que aparecieron simultáneamente en ambos ojos como el caso de una mujer de 43 años con EE por Candida glabrata posterior a cirugía bariátrica complicada56 o el de una mujer de 62 años con EE por Candida dubliniensis por una fístula entero-cutánea y larga estancia intrahospitalaria con nutrición parenteral57.
Los casos reportados de EE bilaterales por bacterias son muy pocos en la literatura y más raros aún los bilaterales asincrónicos.
En la bibliografía se encontró un caso parecido de EEB bilateral secundaria a K. pneumoniae y absceso hepático en un varón de 57 años sin antecedentes de importancia pero, a diferencia de nuestro caso, la aparición de la endoftalmitis fue simultánea en ambos ojos y al momento del diagnóstico el paciente presentaba ya un cuadro de septicemia con compromiso hepático, ocular, urinario y pulmonar58. Se encontró un caso de un paciente inmunodeprimido con EEB bilateral simultánea secundaria a un cuadro de septicemia por Staphylococcus warneri producida por una picadura de avispón Vespa Crabro, que fue tratado precozmente con terapia antibiótica y cirugías vitreorretinales, pero con un pobre resultado visual59. También se publicó un caso de EEB bilateral simultánea por Streptococcus pneumoniae en un varón de 56 años con fiebre e inestabilidad hemodinámica por una endocarditis que recibió punción e inyección de vancomicina, ceftazidima y dexametasona intravítreos y antibióticos sistémicos con mal resultado en ojo derecho (no percepción luminosa) y muy buen resultado en ojo izquierdo (20/25)60. Se publicó otro caso de EEB bilateral simultánea por Staphylococcus aureus resistente a la meticilina (EARM) en un atleta joven sano con infecciones de piel y tejidos blandos recurrentes que desarrolló un absceso de sutura después de la extracción de los tornillos insertados en el momento de la reparación de la fractura tibial. El absceso de la sutura se complicó con un absceso pélvico 3 meses después con la consiguiente diseminación del EAMR y endoftalmitis bilateral simultánea tratada con vitrectomía diagnóstica y terapéutica e inyección de vancomicina, ceftazidima y dexametasona intravítrea, vancomicina sistémica y drenaje del absceso pélvico con excelente resultado visual de 20/20 en ambos ojos61. También encontramos otro caso de una mujer diabética de 48 años con EEB por EARM bilateral simultánea que se complicó aún más con émbolos sépticos, endocarditis, osteomielitis y poliartralgia séptica. Su visión no se recuperó a pesar de la terapia antibiótica intravítrea y sistémica agresiva y la vitrectomía bilateral urgente62. En la última revisión se encontró otro caso publicado recientemente de EEB bilateral simultánea observada en un hombre de 35 años, previamente sano, durante su ingreso en un centro regional de quemados después de una lesión por quemadura de un dispositivo de cigarrillo electrónico. Esta complicación se ha informado solo dos veces en pacientes quemados después de lesiones por quemaduras extensas y potencialmente mortales. Este paciente se sometió a debridamiento quirúrgico e injerto de piel de espesor parcial de quemaduras no importantes según el estándar de práctica. En el postoperatorio desarrolló dolor ocular bilateral, enrojecimiento y fotofobia, y posteriormente fue diagnosticado de EEB bilateral secundaria a una infección por Staphylococcus aureus de la herida por quemadura. Tras ingreso por oftalmología y tratamiento con antibióticos sistémicos e intravítreos se recuperó por completo tanto de las quemaduras como de la endoftalmitis63.
Christensen y colaboradores en 2004 publicaron 4 casos de EEB bilaterales: un hombre de 55 años con endocarditis y EEB bilateral simultánea avanzada (panoftalmitis) por Streptococcus pneumoniae diagnosticado en el hemocultivo, y tratado con antibióticos sistémicos e intravítreos y varias vitrectomías quedando con una AV de 20/100 aproximadamente en ambos ojos; un hombre de 70 años con un absceso subdural a nivel lumbar con una EEB bilateral (con diferencia de 5 días entre un ojo y otro) clasificada como difusa posterior por Streptococcus pneumoniae diagnosticado en el hemocultivo y tratado con antibióticos sistémicos e intravítreos y varias vitrectomías quedando con no percepción de luz en ambos ojos; otro hombre de 57 años con diabetes tipo 2 e infección del tracto urinario con una EEB bilateral (con diferencia de 5 días entre un ojo y otro) clasificada como focal posterior en ojo derecho y difusa posterior en ojo izquierdo por Staphylococcus aureus diagnosticado en los cultivos de sangre y orina y tratado con antibióticos sistémicos e intravítreos en ambos ojos y varias vitrectomías solo en ojo izquierdo, quedando con una AV de 20/30 en ojo derecho y menor a 20/400 en ojo izquierdo; y finalmente una mujer de 80 años con un absceso en una prótesis de cadera izquierda y EEB bilateral simultánea clasificada como difusa posterior por Morganella morganii diagnosticada en el hemocultivo y en los cultivos del vítreo y del absceso de cadera, y tratado con antibióticos sistémicos e intravítreos y vitrectomía en ambos ojos quedando con no percepción de luz en ambos ojos. El hemocultivo fue positivo en los 4 casos, mientras que las muestras vítreas fueron positivas en los casos 1 y 4 y negativas en los otros 2 casos. El foco primario de infección fue identificado en todos los casos. La mayoría de los ojos fueron a la ceguera (5 de 8)64.
En un estudio retrospectivo de todos los casos de EE diagnosticados en el Servicio de Oftalmología del Hospital General La Mancha Centro (Alcázar de San Juan, España) entre 1996 y 2011 se encontraron 9 casos, de los cuales 2 fueron bilaterales. En esta serie solamente uno de los dos casos fue de etiología fúngica, pero no se especificó si el cuadro bilateral fue de aparición simultánea o sucesiva ni el tiempo entre uno y otro. El hemocultivo fue positivo en 4 casos, recuperándose 2 bacilos Gram-negativos, una bacteria Gram-positiva y una levadura de la especie Candida, respectivamente. Todos los pacientes presentaron alguna enfermedad predisponente y la diabetes mellitus fue la más frecuente (4 casos). La agudeza visual global fue menor de 20/200 en 5 casos (se han incluido el caso sin percepción de luz y el ojo enucleado), y mayor de 20/40 en 3 de los 9. El pronóstico visual fue pobre y se relacionó con el aislamiento de microorganismos virulentos y el retraso en el tratamiento. Vancomicina y ceftazidima constituyeron una buena elección para el tratamiento empírico de la EEB, mientras que para el tratamiento empírico de endoftalmitis candidiásica se recomendó anfotericina B liposomal y fluconazol o voriconazol como segundo escalón terapéutico. Los autores consideraron primordial combinar tratamiento sistémico con intravítreo a fin de tratar el foco de infección y la septicemia, consiguiendo así una mayor eficacia terapéutica. De hecho, la evolución de los pacientes fue peor cuando se utilizó una única vía de administración65.
Una revisión sistemática de un total de 342 casos de EEB informados entre 1986 y 2012 fue publicada en 2014 por Jackson y colaboradores. Las condiciones predisponentes estaban presentes en el 60%, más comúnmente diabetes, uso de drogas intravenosas y malignidad. Se encontró un foco de infección extraocular en un 64% de los casos. Las fuentes de infección más comunes fueron hígado, pulmón, endocardio, tracto urinario y meninges. Las características sistémicas —como fiebre— estaban presentes en el 74%, hipopión en el 35% y ausencia de visión del fondo de ojos en el 40%. El retraso diagnóstico ocurrió en el 26%. Los hemocultivos fueron positivos en el 56% y al menos una muestra intraocular fue positiva en el 58% (que comprende el 26% de muestras de la cámara anterior, el 59% de punciones vítreas y el 41% de muestras de vitrectomía). En todo el mundo, las infecciones por Gram-negativos (55%) fueron más frecuentes que las infecciones por Gram-positivos (45%), especialmente en Asia. Las bacterias Gram-negativas más comunes fueron K. pneumoniae (27%), Pseudomona aeruginosa (6%) y Neisseria meningitidis (5%). Las bacterias Gram-positivas más comunes fueron Staphylococcus aureus (10%), Streptococcus del grupo B (6%), Streptococcus pneumoniae (5%) y especies de Nocardia (3%). El 78% de todos los casos de EEB por K. pneumoniae se originó en Asia oriental. Durante la última década, el 11% de los ojos fue tratado con antibióticos sistémicos solos, el 10% con antibióticos intravítreos solos, el 36% con antibióticos sistémicos más intravítreos y el 20% con antibióticos sistémicos más intravítreos más vitrectomía por pars plana. Los antibióticos intravítreos más utilizados fueron la vancomicina (para la infección por Gram-positivos) y la ceftazidima (para los Gram-negativos). La mediana de la agudeza visual final fue 20/100, con un 44% peor que 20/200. Entre todos los casos, el 24% requirió de evisceración o de enucleación y la mortalidad fue del 4%. Tanto la dexametasona intravítrea como la vitrectomía se asociaron con una probabilidad significativamente mayor de retener 20/200 o mejor y significativamente menos evisceraciones o enucleaciones66.
Una revisión retrospectiva de casos de EE durante 21 años entre 1999 y 2020 en un centro terciario de Nueva Zelandia reveló lo siguiente: se encontraron casos de EE en 78 ojos de 62 sujetos: 51,3% fueron ojos derechos, 22,6% fueron casos bilaterales; la diabetes fue el factor de riesgo más común (38,7%); el 27,4% se presentó directamente a oftalmología y 17,4% tuvo un mal diagnóstico inicial; el 79,0% se presentó con agudeza visual reducida pero sólo el 43,5% presentó dolor inicial; un hipopión estuvo presente en solo el 16,7% de los casos, pero vitreítis en un 82,1%, coriorretinitis en 25,6% y vasculitis en 5,1%; las bacterias Gram-positivas fueron los agentes causales más comunes (51,3%), seguidas por hongos (26,9%) y recién por bacterias Gram-negativas (21,8%); una pérdida visual severa ocurrió en el 42,3% de los ojos y un 9% requirió de evisceración (3,8%) o de enucleación (5,1%). La agudeza visual inicial fue un factor predictor significativo de resultado visual final. Todos los sujetos recibieron antibióticos empíricos sistémicos y/o terapia antifúngica. El 88,5% de los ojos recibió tratamiento intravítreo antibiótico y/o antifúngico, de los cuales un 19,2% de los ojos se sometió a vitrectomía primaria, mientras que un 69,2% de los ojos se supeditaron a aspirado vítreo e inyección de antibióticos/antifúngicos intravítreos (“punción e inyección"). Se realizó una vitrectomía subsecuente en 37,2% de los ojos. Se produjo un desprendimiento de retina regmatógeno en el 6,4% de los ojos. Como datos de interés con respecto de nuestro caso, un sujeto se presentó en dos ocasiones separadas con EE bilateral por hongos con tres años de diferencia; este sujeto tenía un diagnóstico de tumor neuroendócrino y cáncer de endometrio y estaba en nutrición parenteral total. El sitio distal de la infección fue una infección de la línea venosa central y tenía una EE por Candida parapsilosis en ambas ocasiones. Un 10,3% de las EE fueron por K. pneumoniae; de ellos, un 50% era de ascendencia maorí, un 62,5% era diabético, un 50% tenía antecedentes de enfermedad hepatobiliar, y el resultado visual fue muy pobre (50% de ojos quedaron con visión de no percepción luminosa o movimientos de manos y un 37,5% fue eviscerado o enucleado)67.
Finalmente, en nuestro conocimiento y luego de una exhaustiva búsqueda bibliográfica, este es el primer caso publicado de una EEB bilateral asincrónica por K. pneumoniae con una prolongada diferencia de un año y 2 meses en el comienzo de los síntomas entre un ojo y otro. El origen fue un absceso hepático que se formó luego de una cirugía de colecistectomía y que persistió silente durante casi 18 meses sin un adecuado tratamiento, lo que produjo bacteriemias transitorias y causó las endoftalmitis con un año y 2 meses de diferencia entre un ojo y otro. Se produjo primero una endoftalmitis difusa ántero-posterior en ojo izquierdo que terminó en pérdida visual y ptisis bulbi por el retraso en el diagnóstico inicial y en el tratamiento instaurado, y luego una endoftalmitis focal en ojo derecho que conservó el órgano y una visión de 20/20 por la sospecha diagnóstica precoz y el rápido tratamiento instaurado. Debido al curso clínico de la enfermedad y al perfil de resistencia antibiótica, la hipótesis más probable es que se trate de una cepa hipervirulenta de K. pneumoniae de rápida diseminación global en las últimas décadas.
Conclusión
El presente caso es un ejemplo de que la endoftalmitis endógena bacteriana es una urgencia oftalmológica que pone en peligro la visión y puede asociarse con morbilidades sistémicas potencialmente mortales. Dado que el pronóstico se asocia a un tratamiento precoz que incluye antibióticos intravítreos y sistémicos, el diagnóstico temprano de la infección supone un reto para médicos clínicos, oftalmólogos y microbiólogos.
Referencias