CASOS CLÍNICOS
Síndrome de Vogt-Koyanagi-Harada (VKH-like) luego de administración de nivolumab
Pablo Venancio, Martina Faretta, Andrea Valeiras
Servicio de Oftalmología del Hospital Interzonal General de Agudos R. Rossi, La Plata, Buenos Aires, Argentina
Recibido: 22 de mayo de 2022.
Aprobado: 3 de noviembre de 2022.
Autor corresponsal
Dr. Pablo Venancio
Calle 37, nro. 183
(1900) La Plata, Argentina
+54 221 4828821
venanciopablo@hotmail.com
Oftalmol Clin Exp (ISSNe 1851-2658)
2022; 15(4): e489-e494.
Resumen
Objetivo: Presentar un caso clínico del síndrome de Vogt Koyanagi Harada like por terapia antineoplásica con inhibidores de puntos de control inmunitario como lo es el nivolumab en un paciente con antecedente de cáncer de riñón estadio III.
Caso clínico: Paciente masculino de 67 años diagnosticado en 2004 de cáncer de riñón cuyo tratamiento inicial consistió en resección quirúrgica con resultados satisfactorios, hasta que en el año 2015 en una tomografía computada de control se evidenciaron ganglios linfáticos infiltrados. Se inició tratamiento oncológico con diferentes drogas antineoplásicas pertenecientes al grupo de inhibidores de tirosina quinasa sin obtener resultados terapéuticos favorables, por lo que se decidió iniciar tratamiento con nivolumab (anticuerpo monoclonal) en 2017. Meses más tarde ese fármaco debió ser suspendido porque el paciente presentaba un cuadro compatible con Vogt Koyanagi Harada like luego de habérsele administrado nivolumab, lo cual llevó a considerarse un grave efecto adverso oftalmológico.
Conclusión: En pacientes tratados con nivolumab es importante la realización del control y seguimiento oftalmológico ante la posible aparición de efectos adversos como el VKH-like.
Palabras clave: síndrome de Vogt Koyanagi Harada, VKH-like, uveítis, efectos adversos, anticuerpos monoclonales, nivolumab.
Vogt-Koyanagi-Harada (VKH-like) syndrome after administration of nivolumab
Abstract
Objective: To present a clinical case of Vogt Koyanagi Harada like syndrome due to antineo-plastic therapy with immune checkpoint inhibitors (ICIs) such as nivolumab in a patient with a history of stage III kidney cancer.
Case report: A 67-year-old male patient diagnosed in 2004 with kidney cancer whose initial treatment consisted of surgical resection with satisfactory results, until in 2015 a control comput-ed tomography showed infiltrated lymph nodes. Oncological treatment was started with different antineoplastic drugs belonging to the group of tyrosine kinase inhibitors without obtaining favor-able therapeutic results, so it was decided in 2017 to start treatment with nivolumab (monoclonal antibody). Months later, said drug had to be suspended because the patient presented symptoms compatible with Vogt Koyanagi Harada like after the administration of nivolumab, considering this a serious ophthalmological adverse effect.
Conclusion: In patients treated with nivolumab, ophthalmological control and follow-up is im-portant, given the possible appearance of adverse effects such as VKH-like
Keywords: Vogt Koyanagi Harada, VKH-like, uveítis, adverse effects, monoclonal antibodies.
Síndrome de Vogt-Koyanagi-Harada (VKH-like) após a administração de nivolumab
Resumo
Objetivo: Apresentar um caso clínico de síndrome de Vogt Koyanagi Harada-like devido à terapia antineoplásica com inibidores de pontos de controle imunológico como o nivolumab em um paciente com história de câncer renal no estágio III.
Caso clínico: Homem de 67 anos diagnosticado em 2004 com cancro do rim cujo tratamento inicial consistiu na ressecção cirúrgica com resultados satisfatórios, até que em 2015 uma tomografia computadorizada de controlo revelou linfonodos infiltrados. O tratamento do câncer foi iniciado com diferentes drogas antineoplásicas pertencentes ao grupo dos inibidores da tirosina quinase sem obter resultados terapêuticos favoráveis, por isso foi decidido iniciar o tratamento com nivolumab (um anticorpo monoclonal) em 2017. Meses depois, essa droga teve que ser suspensa porque o paciente apresentou quadro compatível com Vogt Koyanagi Harada como após administração de nivolumab, o que levou a considerar um efeito adverso oftalmológico grave.
Conclusão: Em pacientes tratados com nivolumab é importante realizar controle e acompanhamento oftalmológico diante do possível aparecimento de efeitos adversos como VKH-like.
Palavras-chave: síndrome de Vogt Koyanagi Harada, VKH-like, uveíte, efeitos adversos, anticorpos monoclonais, nivolumab.
Introducción
El síndrome de Vogt Koyanagi Harada (VKH) es una afección que en su forma completa produce uveítis difusa bilateral con compromiso del sistema nervioso (meningismo), auditivo (acúfenos e hipoacusias en frecuencias altas) y cutáneos (vitíligo)1. Aunque su etiología es desconocida, el mecanismo fisiopatológico se debería a una respuesta autoinmune dirigida contra los melanocitos1.
Algunos grupos farmacológicos antineoplásicos como los inhibidores de puntos de control inmunitarios (ICI), como el nivolumab, se relacionan con la aparición de síndrome similar al VKH, por lo que se ha denominado como VKH like2-5. Los ICI estimulan el sistema inmunitario y causan varios efectos secundarios de tipo autoinmune que se conocen, como eventos adversos relacionados con el sistema inmunitario (irAE)6. El nivolumab es un anticuerpo monoclonal humano de tipo inmunoglobulina G4 que se une al receptor de muerte programada 1 (PD-1) y bloquea su interacción con PD-L1 y PD-L2 potenciando la respuesta de los linfocitos incluyendo respuestas antitumorales2. En oftalmología, la uveítis y el ojo seco se encuentran entre los irAE conocidos7-8. Teniendo en cuenta que estos fármacos son parte del arsenal terapéutico utilizado para el tratamiento de patologías oncológicas en la actualidad, el propósito de este trabajo es informar un caso de un paciente con síndrome de Vogt Koyanagi Harada (VKH) like luego de administración de nivolumab.
Caso clínico
Paciente masculino de 67 años fue diagnosticado de cáncer de riñón estadio III en 2004. El tratamiento consistió en resección quirúrgica que obtuvo resultados satisfactorios, hasta que en el año 2015 en una tomografía computada de control se evidenciaron ganglios linfáticos infiltrados. Se inició tratamiento oncológico con sunitinib —que se mantuvo por 2 años y medio— con estabilidad de la enfermedad de base. Luego se administraron diferentes drogas antineoplásicas pertenecientes al grupo de inhibidores de tirosina quinasa (everolimus, pazopanib) sin obtener resultados terapéuticos favorables, por lo que en julio de 2017 se decidió iniciar tratamiento con nivolumab (anticuerpo monoclonal) a una dosis de 3 mg/kg administrado por vía intravenosa durante 60 minutos cada 2 semanas.
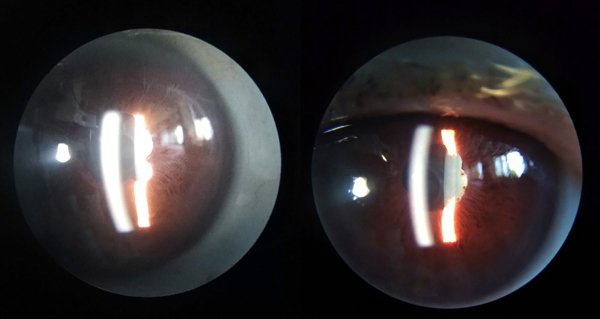
Luego de 4 meses del inicio de nivolumab (fines de 2017) el paciente refirió disminución de la agudeza visual (AV) bilateral con dolor y enrojecimiento ocular, pero no consultó a ningún oftalmólogo. Su oncólogo suspendió nivolumab por efectos adversos oculares y por falta de respuesta de la enfermedad de base, e indicó reiniciar terapia con axitinib y finalmente con pazopanib. En octubre de 2019, el paciente fue referido a nuestro servicio para evaluación por disminución de la agudeza visual (AVMC 6/10 OD y 10/10 OI). En la biomicroscopía de ambos ojos (AO) se constataron precipitados queráticos intermedios a gruesos, difusos, células en cámara anterior de 3x y sinequias posteriores (figs. 1 y 2). La presión intraocular era de 40/20 mmHg en OD y en OI respectivamente. En el fondo de ojos se constató palidez de papila y atrofia peripapilar, retina aplicada y despigmentación difusa (signo de sunset glow fundus) por la afectación del epitelio pigmentario de la retina (figs. 3 y 4).

Figuras 1 y 2. Biomicroscopía de ambos ojos: se observan precipitados queráticos intermedios a gruesos, difusos, células en cámara anterior de 3x y sinequias posteriores.
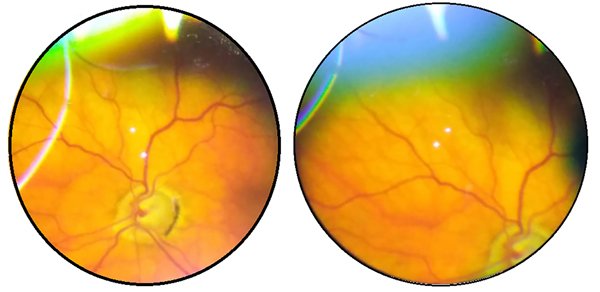
Figuras 3 y 4. Fondo de ojos derecho e izquierdo: palidez de papila y atrofia peripapilar, retina aplicada y despigmentación difusa (sunset glow fundus).
Teniendo en cuenta los antecedentes clínicos del paciente, se interpretó el cuadro como un VKH-like y se inició tratamiento con meprednisona oral 20 mg/kg/día e hipotensores oculares tópicos (timolol + dorzolamida). La respuesta antiinflamatoria fue satisfactoria ya que en los controles subsiguientes no se observaban precipitados queráticos ni células en cámara anterior; sin embargo, la PIO en OD persistió elevada pese al tratamiento hipotensor. En la gonioscopía se constató ángulo cerrado con sinequias en los 360 grados, por lo que se inició acetazolamida oral 250 mg 3 veces por día (figs. 5 y 6) y se programó cirugía de implante de válvula de Ahmed en OD, la que se realizó en marzo 2021. En la actualidad no presenta actividad inflamatoria ocular. La AVMC es movimiento de manos en OD y 10/10 en OI. La presión intraocular en OD es de 10 mmHg sin tratamiento y en el OI es de 14 mmHg con dos drogas. En el fondo de ojos persiste en palidez papilar con retina aplicada y despigmentación difusa en ambos ojos.
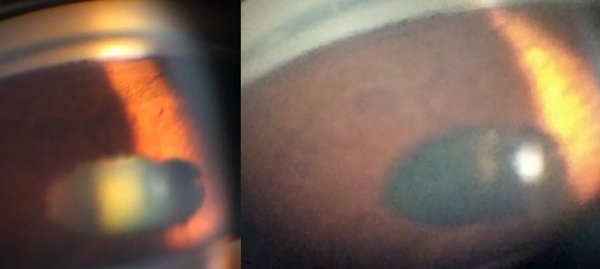
Figuras 5 y 6. Gonioscopía de ambos ojos: ángulo cerrado con sinequias en los 360°.
Discusión
El presente estudio de un caso expresa la relevancia de tener en cuenta que existe la posibilidad del desarrollo de un efecto adverso oftalmológico en personas que requieran de la utilización de nivolumab, que se manifiesta de forma similar al síndrome VKH. En nuestro caso, se trató de un paciente con cáncer de riñón tratado con este fármaco que posteriormente desarrolló una uveítis bilateral granulomatosa diagnosticada por su relación clínica y posterior evolución como un VKH-like. Nuestro paciente también tuvo glaucoma secundario, por lo que además de suspender el tratamiento de nivolumab —y utilizar tratamiento con corticoides sistémicos para el control de la inflamación— posteriormente requirió una cirugía de glaucoma en uno de sus ojos.
El VKH está estrechamente relacionado con el HLA DR4 y aunque el mecanismo permanece desconocido, se presume una enfermedad autoinmune que involucra a los melanocitos1. El bloqueo PD-L1 por nivolumab activaría a células T específicas para melanocitos, ya que los antígenos específicos de estos podrían presentarse por el complejo HLA1. Los ICI han mejorado notablemente los tratamientos oncológicos; sin embargo, los efectos adversos inmunomediados suelen presentarse con relativa frecuencia6-8. Entre estos se encuentran uveítis, vitíligo, enterocolitis, hepatitis, poliartritis, LES, diabetes, pancreatitis, hipofisitis, hipotiroidismo y miastenia6. La mayoría de estos responden a corticoides, los que deben iniciarse rápidamente y en dosis suficientes. También se debe suspender la administración de los ICI y evaluar discontinuar permanentemente si el efecto adverso fue severo o potencialmente mortal6-8.
Aunque se ha informado uveítis bilateral como efecto secundario de la administración de nivolumab, deseamos destacar el aspecto original del presente trabajo, ya que tras haber realizado una extensa búsqueda bibliográfica en medios electrónicos se han encontrado muy pocos trabajos que hayan comunicado algo similar. En 2017 se publicó el primer caso donde se estableció una potencial relación entre el nivolumab y el desarrollo de un efecto adverso oftalmológico2. En ese caso, durante la evolución de una paciente con melanoma y metástasis, desencadenó un VKH-like con hipertensión ocular que, a diferencia de nuestro paciente, pudo controlarse con gotas de hipotensores oculares y no requirió de ningún procedimiento quirúrgico. En el mismo año se publicó un trabajo similar donde se presentó un VKH-like en una mujer de 92 años tratada por melanoma metastásico3.
En 2019 fue publicado un caso de una paciente femenina de 63 años que desarrolló un VKH-like con nivolumab para el tratamiento de melanoma cutáneo4. En este caso, el cuadro oftalmológico se manifestó con disminución de agudeza visual y uveítis panuveítis granulomatosa bilateral. Se constató la afectación retinal mediante retinofluoresceinografía y tomografía de coherencia óptica. Ante la sospecha de la relación con el nivolumab, los autores suspendieron el tratamiento y el cuadro resolvió completamente sin dejar secuelas 4 meses más tarde. Al igual que en nuestro caso, el compromiso ocular fue bilateral y se requirió tratamiento hipotensor ocular. Pero además, por su fracaso, nuestro paciente necesitó colocación de válvula de Ahmed y lamentablemente presentó lesiones secuelares en el fondo de ojos (despigmentación de retina y palidez papilar).
En conclusión, los nuevos enfoques terapéuticos de pacientes oncológicos con inhibidores de puntos de control inmunitario (ICI) como lo es el nivolumab suponen una excelente opción terapéutica con lo que se ha conseguido alcanzar mejores tasas de respuesta y de supervivencia a largo plazo. Sin embargo, los efectos adversos inmunomediados deben considerarse, diagnosticarse precozmente y ser tratados oportunamente para no generar problemas adicionales en el paciente, y empeorar así su calidad de vida.
Referencias