Biomarcadores de imágenes de DMAE
Dres. Joaquín Bafalluya-b, Camila Challiolc, Gabriela Gayd, Alejandro Lavaquee, Carolina Pozzonif, Ignacio Zeoliteg
a Director del Departamento de Mácula, Servicio de Oftalmología, Hospital Centenario, Rosario, Argentina. b Director Médico Centro de Diagnóstico y Cirugía Ocular Oftalmólogos Especialistas, Rosario, Argentina. c Servicio de Oftalmología, Hospital Italiano de Buenos Aires, Argentina. d Departamento de Imágenes del Instituto de la Visión, Buenos Aires, Argentina. e Jefe del Servicio de Retina y Vítreo en el Centro de Especialidades Oftalmológicas, San Miguel de Tucumán, Argentina. f Jefa de la Sección Estudios Complementarios del Servicio de Oftalmología del Hospital Italiano de Buenos Aires, Argentina. g Director médico de Integravisión, Mendoza, Argentina.
INTRODUCCIÓN
Los biomarcadores se consideran herramientas utilizadas en medicina de precisión que poseen un rol clínico y determinante en la guía de decisiones terapéuticas. Se subclasifican según su orientación predictiva, pronóstica o diagnóstica y a su vez pueden ser moleculares, celulares o de imágenes. En este trabajo nos centraremos en analizar y describir los biomarcadores de imágenes de la DMAE.
Biomarcadores en DMAE no neovascular
La presencia de drusas y el análisis de su aspecto (tabla 1) nos permite clasificarlas y utilizarlas de esta forma como biomarcadores de la DMAE no neovascular, acorde con los diferentes métodos de imágenes evaluados.
Tabla 1. Tipos de drusas. Aspectos principales en relación con los diferentes métodos de diagnóstico por imágenes empleados
Clasificación de drusas y características |
Cuticulares |
Depósitos drusenoides subretinales (DDS) |
Drusen
blandos |
Paqui-drusen |
Fotografía color del fondo de ojos |
Grupos de múltiples manchas amarillas o pálidas, redondas y puntiformes de 50-75 μm |
Estructuras drusenoides similares a puntas de alfiler, color grisáceo , 25 a ≥ 1000 μm |
Estructuras blanco amarillentas placoides o en forma de domo 63 a ≥ 1000 μm |
Dispersos
bordes bien definidos
No presentan focos de hiperpigmenta-ción
>63 μm |
Características cercano al infrarrojo |
Disminución de la señal |
Manchas oscuras |
Disminución del brillo |
|
SD OCT |
Debajo del EPR RPE
Patrón en dientes de sierra |
Sobre el ERP |
Debajo del EPR |
Debajo del EPR |
RFG |
Aspecto de “estrellas en el cielo”
Imágenes puntiformes hiperfluore-scentes múltiples |
Sin cambios
Mínima hipofluorescencia |
Mínima hiperfluorescencia en los tiempos tardíos |
|
AF |
Hipoautofluorescentes |
Manchas hipoautofluore-scentes |
Bordes discretamente hiperautofluore-scentes |
|
EDI OCT/SS |
En maculopatía viteliforme gruesa
En atrofia delgada |
Delgada |
Normal |
Gruesa |
Expresión de complicaciones |
AG
MNV |
Forma punteada
MNV tipo 2 y 3
Forma confluente AG |
Si focales: CNV tipo 1, si regresión AG
Si hiper-pigmentación:MNV tipo1, 2 o 3 |
MNV tipo 1 |
Biomarcadores tomográficos en la DMAE neovascular
Desprendimiento del epitelio pigmentario
Los desprendimientos del epitelio pigmentario son causados por la elevación y separación de la monocapa de EPR y su membrana basal de la capa colágena interna de la membrana de Bruch debido a presencia de fluido, sangre, material fibrovascular o drusenoide1.
Se clasifican en:
Drusenoides
Se observan en la maculopatía seca y se asocian a drusen grandes confluentes (Fig. 1). Se ven en el examen clínico como elevaciones blanco amarillentas del EPR. Comúnmente presentan un patrón estrellado de pigmento en su superficie. En la RFG presentan una tenue hiperfluorescencia en tiempos tempranos que se incrementa ligeramente en los tiempos tardíos pero que no presenta filtración (Fig. 1).
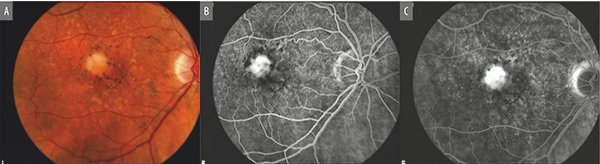
Figura 1. A) Lesión redondeada secundaria a elevación de la retina debido a acumulación de material drusenoide (PED drusenoide). Resulta evidente en este paciente la redistribución de pigmentos. B y C) Angiografía con fluoresceína revela hiperfluorescencia en tiempos tempranos que aumenta en intensidad en las fases tardías. Drusen satélites a la lesión aparecen hiperfluorescentes en tiempos tardíos.
En la ICG permanecen hiperfluorescentes debido al bloqueo de la vasculatura coroidea. En la AF son típicamente iso o hiperfluorescentes. En el OCT se observan como elevaciones de la banda del EPR que pueden tener una apariencia ondulada. Se asocian a la forma seca de DMAE de alto riesgo.
Serosos
Son elevaciones bien demarcadas del EPR debido a una acumulación de fluido en el espacio subretinal, entre el EPR y la membrana de Bruch. Clínicamente se presentan en forma de domo con una coloración amarillo anaranjada y un borde bien demarcado (Fig. 2). En el examen con AF se observa una intensa hiperfluorescencia desde los tiempos tempranos con acumulación del medio de contraste en tiempos tardíos. La ICG muestra lesiones hiperfluorescentes. La FAF revela una lesión HFAF con un halo de hFAF alrededor. En el OCT se observan como elevaciones agudas y bien demarcadas del EPR con un espacio homogéneo e hiporreflectivo por debajo del desprendimiento del epitelio pigmentario de la retina (DEP). Los signos que predicen evolución hacia la neovascularización son la turbidez basal del fluido seroso, la edad del paciente, el diámetro del DEP (mayor a 1000-1500 micras) y la presencia de neovascularización en el ojo contralateral.

Figura 2. Desprendimiento seroso del EPR. Lesión de color anaranjada, bordes nítidos y aspecto bastante homogéneo. Suelen permanecer estables a lo largo del tiempo.
Fibrovasculares
Los DEP vascularizados son los que por definición corresponden a la forma de neovascularización tipo 1. En el examen clínico se pueden observar como lesiones redondeadas y bien delimitadas. La altura del desprendimiento y la regularidad de su superficie puede ser variable. La presencia de un borde irregular es un signo de probable NVC oculta. Otro signo asociado a neovascularización son los exudados lipídicos (Fig. 3).

Figura 3. PED fibrovascular estudiado con angiografía con fluoresceína. Muestra lesión que hiperfluoresce desde tiempo temprano aumentando la acumulación de medio de contraste en fases tardías. El borde nasal de la lesión muestra aspecto irregular. Este patrón aumenta la sospecha de membrana neovascular coroidea.
Hemorrágicas
Las hemorragias por debajo del DEP se ven más oscuras que las subretinales. En la AF se observa escape de medio de contraste en tiempos tardíos. Esta hiperfluorescencia tardía suele tener origen indeterminado. Clínicamente se corresponde con un engrosamiento sólido y poco profundo del EPR (Fig. 4).

Figura 4. DEP hemorrágico. A) Lesión hemorrágica en la región macular del ojo derecho. Los diferentes colores de la hemorragia obedecen a la localización de la sangre. El componente localizado por debajo del neuroepitelio (subretinal) tiene una coloración roja rutilante. Por otro lado, la sangre alojada por debajo del EPR es más oscura. B) En la angiografía con fluoresceína se determina la presencia de un efecto de “bloqueo” de la fluorescencia de fondo por la hemoglobina.
Mixtos
Es la combinación de algunos de los anteriores.
Material hiperreflectivo subretinal
Se detecta mediante el OCT y se observa como acumulaciones de material inespecífico relativamente uniforme y de alta reflectividad por encima del epitelio pigmentario de la retina2. Se sospecha que el material está conformado por varios elementos que incluyen suero, fibrina y células inflamatorias. Su composición varía con el tiempo y la evolución de la enfermedad. Este material no es hiperautofluorescente, a diferencia de la acumulación de material viteliforme que sí lo es. Cuando ese material es indefinido y está localizado en el compartimiento subretinal, se correlaciona con la presencia de exudación de fibrina en la foto color. A medida que el tratamiento avanza el material hiperreflectivo subretinal (MHS) se vuelve más definido y localizado principalmente en el espacio sub EPR. Con el tratamiento el MHS puede resolver, especialmente en los casos en los que es indefinido, pero cuando está bien definido desde el comienzo generalmente deja fibrosis residual debido a que contiene complejos vasculares y elementos fibróticos.
Se observa en ojos con membranas neovasculares recientes y puede persistir durante el tratamiento con antiangiogénicos (anti VEGF). La presencia de MHS se asocia a pobres resultados visuales y mayor cantidad de fibrosis. Su reaparición es signo de exudación recurrente y es un factor de riesgo para la formación de tejido cicatricial, sobre todo cuando el MHS persiste por uno a dos años.
Fluido
La presencia de líquido en paciente con DMAE neovascular es un biomarcador de importancia. Generalmente está relacionada con la indicación de continuar el tratamiento antiangiogénico. Existen básicamente tres compartimentos donde puede acumularse fluido (Fig. 5)3, como se describe a continuación:
1. Fluido intrarretinal: generalmente forma quistes a diferentes niveles en el interior de la retina. Ha sido asociado a mal pronóstico visual por lo que se aconseja tener baja o nula tolerancia a la presencia de líquido en este compartimento.
2. Fluido subepitelio pigmentario: puede formar parte del DEP seroso o fibrovascular.
3. Fluido subretinal: típicamente se localiza por arriba del EPR y por debajo de los fotorreceptores. Generalmente se lo asocia a membranas neovasculares tipo I. Trabajos recientes consideran que este fluido podría tener cierto efecto protector de la agudeza visual. Por esta razón podría considerarse algún grado de tolerancia a su presencia. Esto último siempre depende del mejor criterio médico.

Figura 5. Diferentes compartimentos donde se puede localizar el fluido proveniente de los vasos anormales. A) Compartimento intrarretinal. Se caracteriza por fluido localizado principalmente en las capas nucleares internas y externas de la retina. Compartimento sub-EPR. Por debajo del epitelio pigmentario. Este fluido suele provenir directamente de la membrana coroidea. B) Compartimento subretinal. Este fluido proviene de los vasos que forman la membrana neovascular coroidea. Suele ocasionar una elevación homogénea del neuroepitelio.
Tubulaciones retinales externas de la retina
Este biomarcador fue descrito por primera vez en 2009 y representa una vía final de degeneración que no es exclusiva de la DMAE, sino que se puede encontrar en una variedad de enfermedades degenerativas de la retina. Su prevalencia varía entre el 8% al 38%5. En cuanto a la DMAE, su presencia se ha asociado más con las MNV clásicas que con las ocultas y los factores de riesgo para su aparición son: la mala agudeza visual basal, la atrofia geográfica, el tamaño de la MNV y el MHS.
Se observan como estructuras redondeadas u ovales interconectadas que se localizan a nivel de la capa nuclear externa. En la OCT se observan como estructuras hiperreflectivas redondas u ovoides con un lumen hipo o hiperreflectivo, y en el enFace OCT se puede observar la red de formaciones tubulares. Se localizan sobre las cicatrices fibrosas, en sitios donde hubo previamente fluido subretinal o adyacentes a las áreas de atrofia. Es importante reconocerlas pues no denotan actividad sino que corresponden a un reacomodamiento de la capa de fotorreceptores en respuesta a la injuria y su presencia se asocia a mal pronóstico visual debido a que representan un daño irreversible de los fotorreceptores.
Signo de la cebolla
Descrito inicialmente por Mukkamala y colaboradores en ojos que presentan desprendimientos vascularizados del epitelio pigmentario6. Se encuentran entre el EPR y la membrana de Bruch y se observan como bandas hiper reflectivas multilaminares, similares a las múltiples capas de una cebolla. Su prevalencia es del 5% al 7% y se postula que su formación se debería a filtraciones constantes de exudación crónica a través de fenestraciones en las MNV tipo 1. Pang y colaboradores analizaron estos depósitos multilaminares y confirmaron histológicamente la presencia de colesterol7. Usualmente se extienden a lo largo del desprendimiento del EPR. En la fotografía libre de rojo y en la cercana al infrarrojo se observan como entidades hiperreflectivas. La presencia de estas bandas persiste a pesar del tratamiento con antiangiogénicos.
Hendiduras precoroideas
Se observan en el OCT como espacios hiporreflectivos entre dos líneas hiperreflectivas: el EPR y la membrana de Bruch. Su prevalencia es de 8,1% a 22,3% y su formación depende de las fuerzas contráctiles hidrostáticas que predisponen a su aparición; por un lado, el tratamiento con antiangiogénicos reduce el componente neovascular pero a su vez la contracción del componente fibroso provoca la separación entre el EPR y la membrana de Bruch, produciendo las hendiduras8. Su presencia se asocia a mayor riesgo de ruptura del EP y/o hemorragia subretinal.
Pseudoquistes
Se observan como espacios hiporreflectivos que carecen de hiperreflectividad en sus bordes. Se ven frecuentemente a nivel de las capas nucleares internas, pero también pueden encontrarse bajo la membrana limitante interna, en capas externas o interesar a todas las capas de la retina. A diferencia de los verdaderos quistes que se asocian a engrosamiento retinal y/o disrupción focal o irregularidad de la retina externa y el epitelio pigmentario, estos pseudoquistes no presentan engrosamiento retinal asociado y sus bordes son más rectos o tienen al menos un borde cóncavo, mientras que los otros son biconvexos o redondeados. Se postula que podrían estar relacionados con degeneración de las células de Muller y es importante diferenciarlos de los quistes verdaderos debido a que estos pseudoquistes no tienen naturaleza exudativa y no ameritan intervención o tratamiento a diferencia de los primeros.
Existe una variante en donde los pseudoquistes se observan en el espacio subretinal y se denominan pseudoquistes subrretinales. Son poco frecuentes de observar y representan una entidad aparte de los pseudoquistes intrarretinales9. En la tabla 2 se describen las diferencias con los quistes.
Tabla 2. Características diferenciales entre quistes y pseudoquistes.
Características |
Quistes |
Pseudoquistes |
Engrosamiento retina |
Presente |
Ausente |
Bordes |
Biconvexos, redondos |
Rectos o cóncavos |
Filtración en la RFG |
Presente |
Ausente |
Cavernas coroideas
Son espacios hiporreflectivos a nivel coroideo que se diferencian de los verdaderos vasos debido a que no tienen borde hiperreflectivo por falta de pared vascular y por la hiperreflectividad del lumen, dada por falta de sangre10. Se observan tanto en el enFace como en el OCT de corte transversal . En la imagen infrarroja se observan hiperreflectivas y tanto la indocianina verde como el OCTA muestran esas zonas como hiporeflectivas o carentes de flujo sanguíneo.
Focos hiperreflectivos
Los focos hiperreflectivos intrarretinales son lesiones detectables mediante OCT, que se especula que corresponden a la activación y la migración del epitelio pigmentario y son un factor predisponente para el desarrollo de la atrofia geográfica11. Tienen una prevalencia de aproximadamente el 40% y se suelen encontrar en el vértice de los drusen. Durante el seguimiento tienden a ser más numerosos y a desplazarse hacia las capas más internas de la retina. El estudio AREDS demostró un riesgo de progresión a la atrofia geográfica cinco veces mayor a lo largo de 5 años en comparación con los controles.
Atrofia geográfica naciente
La atrofia geográfica naciente o inicial se caracteriza por la pérdida de la retina externa sin pérdida de la capa del EP (irora: incomplete retinal pigment epithelium and outer retinal atrophy)12. Las características visibles a la OCT son la retracción de las capas plexiforme externa y nuclear interna (puede haber también rupturas de la MLE y la elipsoides y trazas de hipertransmisión por debajo del EP). La segunda característica es la presencia de una banda hiperreflectiva entre los límites de la capa nuclear externa. El riesgo de progresión a la AG se da en un lapso de aproximadamente 11 meses.
Columnas hiperreflectivas sub EPR
En cuanto a las columnas hiperreflectivas sub EPR, lo que se observa son zonas focales de hipertransmisión por debajo de la línea del EPR. Se especula que se deben a rupturas pequeñas del EPR y se han visto entre 3 y 15 meses previos a la progresión a formas más avanzadas de la enfermedad, especialmente a las formas neovasculares13.
Signo de la doble capa
Este signo se caracteriza por la elevación y separación superficial e irregular del epitelio pigmentario de la retina con respecto de la membrana de Bruch, visualizado mediante el OCT14. En ojos con DMAE no exudativa, este signo sugiere la presencia de membrana neovascular tipo 1 subclínica y son ojos que tienen un riesgo anual mayor de exudación comparado con los que no tienen este signo.
Reflectividad sub drusen
Las variantes en la reflectividad de las estructuras sub drusen son biomarcadores mediante OCT que pueden indicar progresión a la atrofia geográfica en ojos con DMAE intermedia a lo largo de tres años14. Consisten en cuatro clases de hiperreflectividad:
1. Los de baja reflectividad consisten en un core central de menor reflectividad en relación con el resto del material drusenoide circundante de menos de 1000 micras de diámetro.
2. Los de alta reflectividad consisten en un core central de mayor reflectividad en relación con el resto del material drusenoide circundante de menos de 1000 micras de diámetro.
3. Residuos cónicos: son drusas de menos de 1000 micras de diámetro de forma cónica que contienen al menos tres “cores” hiperreflectivos en su interior en relación con el material drusenoide circundante.
4. Drusen con reflectividad dividida: consisten en un drusen de menos de 1000 micras de diámetro cuya reflectividad interna está dividida entre dos niveles: alto y bajo.
Es importante destacar que estas subestructuras son variables, no se mantienen en el tiempo y en el seguimiento muchos subtipos evolucionan hacia otros.
Los drusen con reflectividad dividida y los de baja reflectividad usualmente evolucionan hacia alta reflectividad, y estos últimos usualmente se convierten en residuos cónicos. Estos últimos son los que se asocian a una mayor y más rápida progresión a la atrofia.
Biomarcadores de progresión de atrofia geográfica en la autofluorescencia
Atrofia geográfica (AG)
En la atrofia geográfica (producida por la atrofia y posterior desaparición del EPR) se observa una región bien demarcada de hipoautofluorescencia (uni o multilobular) debido precisamente a la ausencia de epitelio pigmentario4. Se observan en la FAF como parches o zonas de hFAF rodeadas muchas veces de distintos grados de HFAF circundante, principalmente en las zonas de unión. Esta HFAF indica un aumento en la acumulación de la lipofucsina que resultaría tóxica para el EPR y contribuiría a la progresión de la AG (Fig. 6)4.

Figura 6. Hiperautofluorescencia macular de paciente con atrofia geográfica con seguimiento de cuatro años. Se observa cómo las lesiones coalescen produciendo un incremento en el área de atrofia con el paso del tiempo.
Los distintos patrones de HFAF se han clasificado y asociado a velocidades de progresión diferentes y fueron clasificados según el FAM Study Group15 en cinco categorías: ninguna, focal, en banda, parcheada y difusa. Dentro de los subtipos difusos se encuentran: reticular, ramificado, granular fino, goteado y granular fino con spots periféricos punteados.
El grado de progresión de la atrofia geográfica varía según los diversos fenotipos16. Los ojos con autofluorescencia en forma de banda (1,81 mm2/año) y difusa (1,71 mm2/año) mostraron un ritmo de progresión mayor que los que no presentaban áreas de AG (media de 0,38 mm2/año). Dentro de los difusos, los que tenían un patrón trickling (goteado) presentaban un ritmo de progresión mayor (3,02 mm2/año).
La drusas asociadas en la región macular son frecuentes y las zonas de AG suelen aumentar de tamaño con la evolución de la enfermedad e incluir islas de atrofia que se encuentran en las cercanías de la lesión principal16. Sus bordes suelen ser irregulares. En ocasiones la región foveal se respeta hasta etapas tardías. En la FAF suelen mostrar un patrón en “ventana” en el cual la hiperfluorescencia temprana se desvanece en fases tardías. El OCT muestra una discontinuidad de la línea hiperreflectiva que representa al EPR. La retina externa suele tener diferentes formas de atrofia. La coroides también suele estar adelgazada en los casos más típicos.
Resumen de biomarcadores en OCT
A continuación se presentarán conceptos que resumen los aspectos más relevantes comentados previamente, como ser los factores predictivos de evolución (tabla 3) los biomarcadores tomográficos de la DMAE neovascular (tabla 4) y los biomarcadores presentes en el OCTA (tabla 5).
Tabla 3. Factores predictivos de evolución
Mayor riesgo de NVC |
Mayor riesgo de AG |
Tipos de drusen (DDS) |
Atrofia geográfica naciente |
Mayor carga de drusen (número/volumen) |
Regresión de drusas |
Columnas hiperreflectivas sub EPR |
Reflectividad subdrusen |
Tabla 4. Biomarcadores tomográficos de la DMAE neovascular
Biomarcadores de actividad |
Biomarcadores de pronóstico visual |
Signos de no exudación |
Fluido intrarretinal
Fluido subretinal
Desprendimiento del EP
Material hiperreflectivo
Aumento del espesor retinal |
Indemnidad de la membrana limitante externa/zona elipsoidal
Fluido intraretinal
Espesor foveal
Espesor coroideo
DEP/signo de la doble capa |
Cambios degenerativos:
Degeneración cistoidea o pseudoquistes
Tubulaciones externas
Signo de la cebolla
Cambios coroideos:
Hendiduras precoroideas
Cambios atróficos:
Cavernas coroideas
Activación del EPR/depósitos cristalinos
Focos hiperreflectivos |
El OCT es un estudio complementario cuali y cuantitativo, por lo que se sugiere indicar un OCT en un paciente con DMAE en las siguientes situaciones:
• Hacer diagnóstico inicial de la DMAE
• Clasificación/subtipo
• Detectar biomarcadores
• Control de tratamiento (en caso DMAE neovascular).
• Siempre se recomienda seguir las sugerencias de su médico tratante.
Conceptos en relación a terapéutica y biomarcadores:
• Pseudoquistes en atrofia: no indicada terapia antiangiogénica.
• SRF asociado a drusen: no indicada terapia antiangiogénica.
• Lesión viteliforme adquirida: no indicada terapia antiangiogénica.
• PEVAC: no responde a terapia antiangiogénica.
• Exudativa no neovascular AMD (responde a terapia antiangiogénica).
Biomarcadores en el OCTA
Se esquematizan en la tabla 5.
Tabla 5. Biomarcadores en el OCTA
MNV |
Activa |
Inactiva |
Forma |
Bien definida (rueda de encaje, abanico de mar) |
Vasos filamentosos largos |
Ramificación |
Numerosos capilares diminutos |
Vasos grandes, escasos y maduros |
Anastomosis y loops |
Presentes |
Ausentes |
Morfología de los vasos terminales |
Arcadas periféricas |
Apariencia de árbol muerto |
Halo perilesional hipointenso |
Presencia |
Ausencia |
Detección de membranas neovasculares quiescentes en OCTA
La membrana neovascular quiescente es un tipo de neovascularización que presenta una muy baja incidencia de activación a lo largo del tiempo17-18. Es aconsejable un seguimiento de estas lesiones y tratarlas solamente si existe exudación intra o subretinal.
Son signos indirectos de la detección de una membrana neovascular quiescente la visualización en el OCT estructural, tanto de un desprendimiento plano del epitelio pigmentario como de un desprendimiento puntiagudo o en pico, cuyo mayor diámetro lineal se incrementa a lo largo del seguimiento18.
El desprendimiento vascularizado parecería ser un biomarcador predictivo de activación en pacientes con MNV quiescentes17-18.
Uno de los signos que predeciría la activación es la exudación subretinal en el OCT estructural; sin embargo, esto constituye a su vez un signo típico de una MNV menos agresiva15. En otro estudio reciente se estudiaron ojos con DMAE con al menos un drusen grande (>125 μm) en un ojo donde el hallazgo en el OCT estructural del SIRE implica que esos ojos tienen un mayor riesgo de tener una MNV quiescente, con lo cual se recomienda un seguimiento frecuente y una vigilancia domiciliaria constante por parte de los pacientes19.
Se definió como SIRE al conjunto de características que permiten diferenciar a los desprendimientos planos del EPR de las elevaciones drusenoides, dado que los ojos que tienen SIRE conllevan un riesgo elevado de presentar MNV subclínicas. Estas características son:
• El largo mínimo para la elevación de RPE debe ser > 1000 μm.
• La altura de la elevación del RPE debe ser inferior a 100 μm.
• La morfología general de las lesiones es generalmente plana. Esto contrasta con los desprendimientos drusenoides del EPR que tienden a ser más abovedados o redondeados.
• Todas las elevaciones del EPR presentan algún grado de irregularidad en la superficie en lugar de una capa lisa característica de los desprendimientos de drusenoides del EPR.
• El área debajo de la lesión -el espacio sub-EPR- presenta una reflectividad media de contenido no homogéneo.
Papel actual de la retinofluoresceinografía en la DMAE
La RFG tiene una ventaja fundamental con respecto de los otros métodos de imagen, ya que es una herramienta cualitativa y functional que muestra la localización anatómica y el patrón dinámico del filtrado vascular; pero no es un estudio imprescindible para llegar al diagnóstico inicial20.
Las desventajas son la necesidad de contraste, la posibilidad de reacciones adversas desde leves a severas, la ausencia de resolución en profundidad, la pérdida de definición de detalles con la fuga de contraste y la incapacidad para distinguir entre la vasculatura retinal y la coroidea.
Está indicada cuando el paciente se queja de una nueva metamorfopsia o tiene visión borrosa inexplicable, y/o cuando el examen clínico revela elevación del EPR o de la retina, cuando existe presencia de edema macular, sangre subretinal, exudados o fibrosis subretinal o la OCT muestra evidencia de líquido.
Se sugiere solicitar la angiografía en las siguientes situaciones:
• Detectar la presencia y determinar la extensión, el tipo, el tamaño y la ubicación de la MNV.
• Para detectar MNV persistentes o recurrentes después del tratamiento.
• Para ayudar a determinar la causa de la pérdida visual que no explica el examen clínico.
Cabe destacar que el papel y las indicaciones de la angiografía con fluoresceína evolucionan a medida que se producen avances continuos con el desarrollo del OCT.
Drusen
Duros
En el angiograma aparecen como manchas hiperfluorescentes de pequeño tamaño, de forma redonda, bien contorneadas, evidentes desde la fase inicial de la RFG; su aspecto permanece constante a lo largo de la FA hasta la fase tardía, cuando se desvanecen junto con la fluorescencia coroidea. Representan pequeños “defectos de ventana” del EPR superpuesto, que es delgado y ha perdido su pigmento21-22.
Blando
En el angiograma las drusas blandas aparecen como lesiones redondeadas hiperfluorescentes, de mayor tamaño que las drusas duras, con un contorno mal definido y tienen tendencia a confluir. En los estadios tempranos presentan menor intensidad con respecto de las drusas duras. En la fase tardía la hiperfluorescencia no se expande más allá de los límites observados en las fases tempranas, pero presentan pooling, lo que hace que la hiperfluorescencia permanezca por más tiempo. En el caso de que las drusas sean confluentes se pueden confundir con desprendimiento del EPR y es muy difícil el diagnóstico diferencial entre ambos aspectos (DEP drusenoides)21-22.
Cuticulares
En el caso de las drusas cuticulares, la retinografía presenta un aspecto característico dado que las lesiones son más visibles con este método de examen y tienen un comportamiento específico y característico23. Se presentan como múltiples lesiones hiperfluorescentes del tamaño de un alfiler que tienden a desaparecer en las fases tardías. Su aspecto ha sido comparado con “estrellas en el cielo” o “vía láctea”.
Atrofia geográfica
En la angiografía con fluoresceína estas áreas aparecen hiperfluorescentes y se observan los vasos coroideos con bordes bien definidos, dando una imagen similar a la de un mapa geográfico24. El área hiperfluorescente se mantiene del mismo tamaño en todos los tiempos del angiograma sin expansión en las fases tardías.
Con respecto de la MNV, esta es una patología que se presenta en general asociada a otras tales como desprendimiento del epitelio pigmentario, desprendimiento del neuroepitelio y hermorragias, con lo cual presenta un cuadro angiográfico desafiante para diagnosticarlas es importante mirar el tiempo arterio venoso medio20.
Neovascularización macular tipo 1
Es la anteriormente denominada membrana oculta, que es la que aparece en los tiempos tardíos del angiograma, se caracteriza por23:
a. Un desprendimiento fibroso del EP que aparece como una hiperfluorescencia irregular de contorno poco definido y forma redondeada. Se hace más evidente en el angiograma más tardíamente que la membrana clásica y es más intensa en la fase tardía.
b. Una filtración de origen desconocido que se caracteriza por tener múltiples lesiones hiperfluorescentes que se intensifican en la fase tardía y presentar filtración difusa. Este tipo de membranas está mal contorneado y suelen ser de exudación discreta. La zona de filtración no se puede identificar en las fases iniciales.
Neovascularización macular tipo 2
En la membrana neovascular tipo 2 (anteriormente denominada clásica) la hiperfluorescencia empieza en el tiempo coroideo y continúa aumentando a medida que transcurren los tiempos del angiograma25. Hay que analizar el tiempo arteriovenoso medio en donde se observan las características de la MNV: límite neto, borde irregular, contenido heterogéneo e intensidad alta. La definición es mayor en los períodos precoces donde el borde se ve bien definido; luego, a medida que transcurren los tiempos del angiograma, se va produciendo un llenado progresivo de la misma y en las etapas tardías los bordes de la membrana se desdibujan un poco por el lleno del colorante. Sin embargo, existen hechos que pueden oscurecer los bordes de una membrana neovascular clásica como la sangre, el bloqueo de la fluoresceína dado por hiperplasia del epitelio pigmentario o por tejido fibroso, y los desprendimientos serosos del epitelio pigmentario.
Neovascularización macular tipo 3
Anteriormente denominada proliferación angiomatosa retinal, en el angiograma este tipo de neovascularización imita el aspecto de una MNV oculta, pero con ausencia de desprendimiento del epitelio pigmentario25. Puede aparecer como una pequeña hiperfluorescencia intensa temprana con fuga difusa determinando una hiperfluorescencia difusa tardía e irregular. Por lo general, la anomalía vascular se sitúa en la punta de un vaso retinal.
Cicatriz disciforme
La cicatriz disciforme se tiñe rápidamente y tiene una intensa hiperfluorescencia que permanece bien contorneada sin la presencia de fugas. El contraste de fluoresceína atraviesa la placenta en la circulación fetal, pero en el feto no han sido documentados efectos perjudiciales.
Indocianina verde
La angiografía con verde de indocianina es una técnica de imagen que utiliza un colorante de cianina soluble en agua cuya fluorescencia se encuentra en el rango del infrarrojo cercano (790-805 nm)26. Tiene un pico de absorción espectral a aproximadamente 800 nm, lo cual permite la visualización de la circulación coroidea26.
Esta técnica de imagen facilita la evaluación de formas específicas de DMAE como por ejemplo:
• DEP
• MNV mal definidas
• MNV ocultas
• MNV tipo 3
• Enfermedad polipoide
No está exenta de complicaciones médicas: desde leves hasta incluso serias con casos de muerte, aunque en relación con la fluoresceína son menos frecuentes, pero se debe tener especial cuidado en pacientes con alergia a los mariscos y al yodo (la ampolla contiene un 5% de esta sustancia)27.
Conceptos y conclusiones
Consideraciones importantes respecto de los estudios complementarios
Se sugiere que cada centro donde se realice la angiografía fluoresceínica cuente con un plan de cuidado de emergencia y un protocolo claro para minimizar los riesgos y manejar las posibles complicaciones.
Muy importante especificar al operador qué es lo que se busca en cada imagen solicitada: cortes, grilla macular, modo video, cortes coroideos (simil EDI), imágenes en blanco y negro o color, fotos periféricas en el caso de la RFG o ICG y demás especificaciones.
¿Cuándo y para qué solicitar estudios complementarios en DMAE?
OCT
• Para hacer el diagnóstico inicial.
• Clasificación/subtipo.
• Detección de biomarcadores.
• Control de tratamiento (en caso de DMAE neovascular).
• Monitoreo y manejo de las MNV.
• Individualizar régimen de tratamiento.
RFG
• Para detectar la presencia y determinar la extensión, el tipo, el tamaño y la ubicación de la MNV.
• Para detectar MNV persistentes o recurrentes después del tratamiento.
• Para ayudar a determiner la causa de la pérdida visual que no explica el examen clínico.
OCT-A
• Diferenciar una MNV activa de una quiescente.
• En casos de MNV tipo 1 y tipo 3.
• Poca utilidad:
– ante medios no transparentes (ejemplo, gran hemorragia).
– en presencia de gran DPE.
ICG
• Ante DEP.
• MNV mal definidas.
• MNV tipo 3.
• MNV polipoide/VCP.
• Grandes hemorragias.
FAF
• Para valorar el patrón de AG.
• Para diagnóstico, seguimiento y pronóstico de la AG.
• Para diagnóstico diferencial con otras patologías.
¿Cuándo solicitamos un OCT y qué características o condiciones mínimas debe tener el estudio?
• Mapa de espesores centrado en la fóvea.
• Una o dos líneas que pase por la fóvea.
• Si la fóvea está deformada tener una referencia de esa línea pasando por el nervio óptico, el polo inferior, para tener una certeza de que el “escaneo” del OCT ha pasado por la fóvea.
• Cortes radiales.
• El informe del estudio puede ser en formato digital o impreso. En el caso de ser impreso se debe entregar imágenes de cortes suficientes para poner de manifiesto los hallazgos patológicos y las imágenes, preferentemente en blanco y negro.
REFERENCIAS
1. Karampelas M, Malamos P, Petrou P et al. Retinal pigment epithelial detachment in age-related macular degeneration. Ophthalmol Ther 2020; 9: 739-756. doi:10.1007/s40123-020-00291-5.
2. Leung KFC, Downes SM, Chong V. A retrospective analysis of the effect of subretinal hyper-reflective material and other morphological features of neovascular age-related macular degeneration on visual acuity outcomes in eyes treated with intravitreal aflibercept over one year. Vision (Basel) 2018; 2: 5. doi:10.3390/vision2010005.
3. Souied EH, El Ameen A, Semoun O et al. Optical coherence tomography angiography of type 2 neovascularization in age-related macular degeneration. Dev Ophthalmol 2016; 56: 52-56. doi:10.1159/000442777.
4. Schmitz-Valckenberg S, Holz FG, Bird AC, Spaide RF. Fundus autofluorescence imaging: review and perspectives. Retina 2008; 28: 385-409. doi:10.1097/IAE.0b013e318164a907.
5. Zweifel SA, Engelbert M, Laud K et al. Outer retinal tubulation: a novel optical coherence tomography finding [corrección en Arch Ophthalmol 2012; 130: 856]. Arch Ophthalmol 2009; 127: 1596-1602. doi:10.1001/archophthalmol.2009.326.
6. Mukkamala SK, Costa RA, Fung A et al. Optical coherence tomographic imaging of sub-retinal pigment epithelium lipid. Arch Ophthalmol 2012; 130: 1547-1553. doi:10.1001/archophthalmol.2012.2491.
7. Pang CE, Messinger JD, Zanzottera EC et al. The onion sign in neovascular age-related macular degeneration represents cholesterol crystals. Ophthalmology 2015; 122: 2316-2326. doi:10.1016/j.ophtha.2015.07.008.
8. de Oliveira Dias JR, Zhang Q, Garcia JMB et al. Natural history of subclinical neovascularization in nonexudative age-related macular degeneration using swept-source OCT angiography. Ophthalmology 2018; 125: 255-266. doi:10.1016/j.ophtha.2017.08.030.
9. Motevasseli T, Jhingan M, Bartsch DU et al. Progress evaluation in eyes with geographic atrophy and retina pseudocyst. Ophthalmol Retina 2021; 5: 596-598. doi:10.1016/j.oret.2020.11.005.
10. Querques G, Costanzo E, Miere A et al. Choroidal caverns: a novel optical coherence tomography finding in geographic atrophy. Invest Ophthalmol Vis Sci 2016; 57: 2578-2582. doi:10.1167/iovs.16-19083.
11. Alex D, Giridhar A, Gopalakrishnan M et al. Subretinal hyperreflective material morphology in neovascular age-related macular degeneration: a case control study. Indian J Ophthalmol 2021; 69: 1862-1866. doi:10.4103/ijo.IJO_3156_20.
12. Wu Z, Pfau M, Blodi BA et al. OCT signs of early atrophy in age-related macular degeneration: interreader agreement: Classification of Atrophy Meeting Report 6. Ophthalmol Retina 2021; S2468-6530(21)00093-2. doi:10.1016/j.oret.2021.03.008.
13. Jaffe GJ, Chakravarthy U, Freund KB et al. Imaging features associated with progression to geographic atrophy in age-related macular degeneration: Classification of Atrophy Meeting Report 5. Ophthalmol Retina 2020; S2468-6530(20)30490-5. doi:10.1016/j.oret.2020.12.009.
14. Li M, Dolz-Marco R, Huisingh C et al. Clinicopathologic correlation of geographic atrophy secondary to age-related macular degeneration. Retina 2019; 39: 802-816. doi:10.1097/IAE.0000000000002461.
15. Holz FG, Bindewald-Wittich A, Fleckenstein M et al. Progression of geographic atrophy and impact of fundus autofluorescence patterns in age-related macular degeneration. Am J Ophthalmol 2007; 143: 463-472. doi:10.1016/j.ajo.2006.11.041.
16. Thiele S, Nadal J, Pfau M et al. Prognostic value of intermediate age-related macular degeneration phenotypes for geographic atrophy progression. Br J Ophthalmol 2021; 105: 239-245. doi:10.1136/bjophthalmol-2020-316004.
17. Al-Sheikh M, Iafe NA, Phasukkijwatana N et al. Biomarkers of neovascular activity in age-related macular degeneration using optical coherence tomography angiography. Retina 2018; 38: 220-230. doi:10.1097/IAE.0000000000001628.
18. Wirth MA, Freiberg F, Pfau M et al. Optical coherence tomography angiography in age-related macular degeneration: persistence of vascular network in quiescent choroidal neovascularization. Acta Ophthalmol 2017; 95: 428-430. doi:10.1111/aos.13226.
19. Chen L, Messinger JD, Sloan KR et al. Nonexudative macular neovascularization supporting outer retina in age-related macular degeneration: a clinicopathologic correlation. Ophthalmology 2020; 127: 931-947. doi:10.1016/j.ophtha.2020.01.040.
20. Labrador-Velandia SC, Sanabria MR. Fluorescein angiography indications: changes after optical coherence tomography and antiangiogenics. Optom Vis Sci 2018; 95: 435-442. doi:10.1097/OPX.0000000000001212.
21. Spaide RF, Curcio CA. Drusen characterization with multimodal imaging. Retina 2010; 30: 1441-1454. doi:10.1097/IAE.0b013e3181ee5ce8.
22. Guigui B, Leveziel N, Martinet V et al. Angiography features of early onset drusen. Br J Ophthalmol 2011; 95: 238-244. doi:10.1136/bjo.2009.178400.
23. Balaratnasingam C, Cherepanoff S, Dolz-Marco R et al. Cuticular drusen: clinical phenotypes and natural history defined using multimodal imaging. Ophthalmology 2018; 125: 100-118. doi:10.1016/j.ophtha.2017.08.033.
24. Holz FG, Strauss EC, Schmitz-Valckenberg S, van Lookeren Campagne M. Geographic atrophy: clinical features and potential therapeutic approaches. Ophthalmology 2014; 121: 1079-1091. doi:10.1016/j.ophtha.2013.11.023.
25. Spaide RF, Jaffe GJ, Sarraf D et al. Consensus nomenclature for reporting neovascular age-related macular degeneration data: Consensus on Neovascular Age-Related Macular Degeneration Nomenclature Study Group [corrección: Ophthalmology 2020; 127: 1434-1435]. Ophthalmology 2020; 127: 616-636. doi:10.1016/j.ophtha.2019.11.004.
26. Reinhart MB, Huntington CR, Blair LJ et al. Indocyanine green: historical context, current applications, and future considerations. Surg Innov 2016; 23: 166-175. doi:10.1177/1553350615604053.
27. Meira J, Marques ML, Falcão-Reis F et al. Immediate reactions to fluorescein and indocyanine green in retinal angiography: review of literature and proposal for patient’s evaluation. Clin Ophthalmol 2020; 14: 171-178. doi:10.2147/OPTH.S234858.





