Clasificación
de la DMAE
Dres. Joaquín Bafalluya-b, Camila Challiolc, Gabriela Gayd, Alejandro Lavaquee, Carolina Pozzonif,
Ignacio Zeoliteg
a Director del Departamento de Mácula, Servicio de Oftalmología, Hospital Centenario, Rosario, Argentina. b Director Médico Centro de Diagnóstico y Cirugía Ocular Oftalmólogos Especialistas, Rosario, Argentina. c Servicio de Oftalmología, Hospital Italiano de Buenos Aires, Argentina. d Departamento de Imágenes del Instituto de la Visión, Buenos Aires, Argentina. e Jefe del Servicio de Retina y Vítreo en el Centro de Especialidades Oftalmológicas, San Miguel de Tucumán, Argentina. f Jefa de la Sección Estudios Complementarios del Servicio de Oftalmología del Hospital Italiano de Buenos Aires, Argentina.
g Director médico de Integravisión, Mendoza, Argentina.
INTRODUCCIÓN
La tecnología que se utiliza actualmente y específicamente gracias al OCT ha permitido mejorar la visualización de las estructuras de la retina in vivo y es de gran ayuda para el diagnostico, pero a su vez ha generado algunos cambios en la clasificación, estadificación y seguimiento de la enfermedad. A continuación nos enfocaremos en unificar la clasificación de acuerdo con conceptos universales científicamente aceptados, actualizados y de esta forma poder utilizar una nomenclatura en común entre todos los médicos oftalmólogos.
En la actualidad, la clasificación de la DMAE define tres estadios según la gravedad de la patología: precoz, intermedia y avanzada. Esta última incluye la forma atrófica y la exforma húmeda que expresa la presencia de neovasos y exudación1.
Ferris y colaboradores propusieron la clasificación clínica de la DMAE basada en la evidencia y obtenida a partir del consenso de expertos2. La adopción de esta nueva clasificación sirvió para unificar la terminología, la definición, la escala de gravedad y los tipos de patología de la DMAE usados anteriormente. El sistema final de clasificación, consensuado por un grupo de expertos en DMAE, un neurooftalmólogo, dos presidentes del comité y un metodólogo, se basa en las lesiones observadas en el examen del fondo de ojo localizadas dentro de dos diámetros de disco respecto del centro de la fóvea en personas mayores de 55 años.
Como conclusiones principales:
• Establece como nomenclatura única el término degeneración macular asociada a la edad (DMAE) para definir la enfermedad.
• Diferencia claramente entre la patología y situaciones no consideradas patológicas, como la presencia de drusas pequeñas asociadas al envejecimiento natural de la retina.
• Las drusas se clasifican en tres estadios de gravedad de acuerdo con su tamaño en pequeñas (≤63 μm), medianas (>63 y ≤125 μm) y grandes (>125 μm)3. Se aconseja utilizar como referencia aproximada el tamaño de la vena principal de la retina a nivel del margen del disco óptico (125 μm).
• En relación con las alteraciones pigmentarias se determina como hiperpigmentación o hipopigmentación presentes dentro de los dos diámetros de disco respecto del centro de la mácula sin ninguna otra enfermedad asociada (Fig. 1).
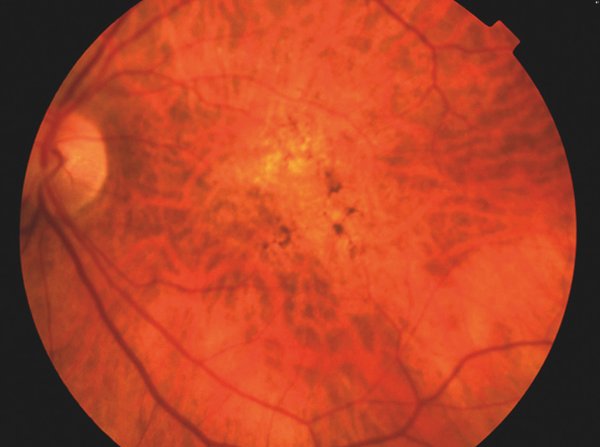
Figura 1. Área de despigmentación del EPR asociada a probable zona de atrofia superior a la fóvea. Evidente redistribución con acúmulo de EPR a ambos márgenes foveales.
En resumen, se clasifica la DMAE precoz como la presencia de drusas medianas sin alteraciones pigmentarias; la DMAE intermedia como la presencia de drusas grandes y/o alteraciones pigmentarias; y la DMAE avanzada como la presencia de atrofia geográfica o neovascularización (Fig. 2)4.

Figura 2. Formas avanzadas de DAME. A) Angiografía con fluoresceína, tiempos tardíos, muestra exudación de medio de contraste secundario a la presencia de una membrana neovascular coroidea. B) Autofluorescencia macular que muestra atrofia geográfica avanzada. Se observa un área de ausencia del EPR (hipoautofuorescencia) que alterna con lesiones hiperautofluorescentes secundarias a alteraciones del funcionamiento del EPR en diferentes estadios.
Esta clasificación -ampliamente aceptada y de fácil aplicación en la práctica clínica- se basa en hallazgos claramente identificables (tamaño de las drusas, cambios pigmentarios). Además, permite estimar el riesgo de progresión a DMAE avanzada en los próximos cinco años, lo cual es esencial para establecer el pronóstico y mejorar la performance terapéutica de forma individualizada5.
La clasificación que se describe a continuación es en base a los hallazgos encontrados en el OCT.
DMAE no neovascular
Es la forma atrófica de la enfermedad y se define como “atrofia geográfica” a la presencia de lesiones atróficas bien delimitadas de la retina externa, con pérdida de fotorreceptores, EPR y coriocapilar. Generalmente el cuadro evoluciona a la pérdida progresiva de la visión6. Se puede estudiar con diferentes métodos de imágenes, cada uno de los cuales revela características específicas. La lesión característica es la presencia de áreas bien demarcadas de hipopigmentación con visibilidad aumentada de los vasos coroideos subyacentes por ausencia de EPR (la autofluorescencia de fondo revela zonas hFAF)6-7. El OCT muestra áreas de hipertransmisibilidad de la luz. La RFG revela hiperfluorescencia temprana sin aumento en tiempos tardíos (efecto ventana) (Fig. 3)8.
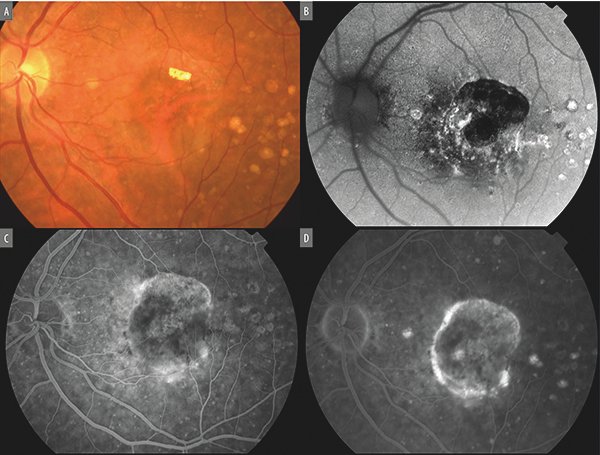
Figura 3. Atrofia geográfica. A) Zona de ausencia del EPR a través de la cual destacan los vasos coroideos. Drusas especialmente localizadas temporal a la fóvea. Presencia de lesión hiperrefringente superior a la fóvea refleja la cronicidad del cuadro. B) Autofluorescencia macular revela amplia área de hipoautofluorescencia por ausencia del EPR. Alrededor, áreas puntuales de hiperautofluoresceínica debido a disfunción en diferentes estadios. C y D) Tiempos tempranos y tardíos de la evaluación por medio de angiografía con fluoresceína revela patrón de “defecto en ventana” en el área de ausencia de EPR.
Clasificación de la forma atrófica según OCT
La clasificación de la forma atrófica mediante el uso de la tomografía de coherencia óptica (OCT) ofrece ciertas ventajas en relación con otros métodos de imágenes9. Con respecto de la foto color, los límites de la región atrófica no siempre son claramente visibles. En la autofluorescencia de fondo (FAF) las áreas de atrofia geográfica aparecen claramente delimitadas, sumado a que esta técnica permite el análisis semiautomático de las imágenes y la cuantificación, pero el uso de la longitud de onda en el rango de los azules es absorbida parcialmente por el pigmento lúteo, lo que dificulta el análisis de la zona foveal. Se puede usar en combinación con la reflectancia cercana al rojo, de manera de poder evaluar la zona foveal10.
La clasificación basada en la OCT tiene varias ventajas. La primera de ella es la posibilidad de evaluar la atrofia en tres dimensiones, incluso permite su estudio a través del modo “en Face”11. Por otro lado, facilita el análisis cualitativo de los cambios y se pueden visualizar lesiones tempranas o precursores de atrofia, incluso antes que en la foto color o la FAF. La principal desventaja es que brinda información solo del sitio por donde atraviesa el escaneo sin brindar una idea general de la lesión. Una de las características más comunes relacionadas con la atrofia es la transmisión aumentada de la señal por debajo de la línea del EPR y hacia la coroides. Esto se define como hipertransmisión (Fig. 4).
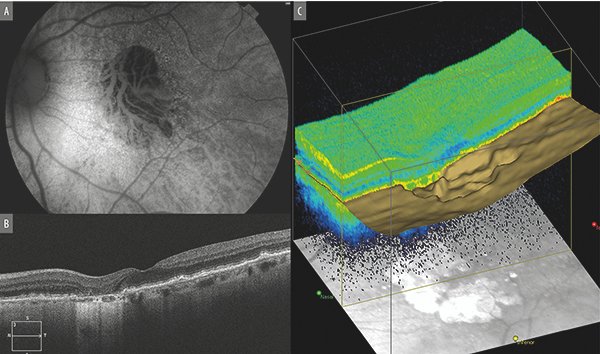
Figura 4. A) Autofluorescencia macular revela visualización de los vasos coroideos en el sector afectado por la atrofia geográfica. B) OCT muestra alteración de la retina externa con hipertransmisión de la luz. C) “enFace” OCT donde se observa con claridad el sector con ausencia del EPR.
Evaluación por medio de la tomografía de coherencia óptica (OCT)
i: incompleta
c: completa
r: implica cambios en el EPR (Retinal Pigment Epithelium)
Si no hay cambios en el EPR no se pone la “r”9-12
ORA: siglas que derivan de outer retinal atrophy para expresarse sobre la atrofia de los componentes de la membrana externa de la retina sin afectar el EPR.
Son aspectos visibles en el OCT.
iRORA
Atrofia incompleta del EPR y la retina externa. En este caso la hipertransmisión se presenta en forma evidente pero discontinua (no homogénea). El EPR está presente pero es irregular o está interrumpido y no se cumplen todos los criterios para definirla como atrofia completa (Fig. 5).
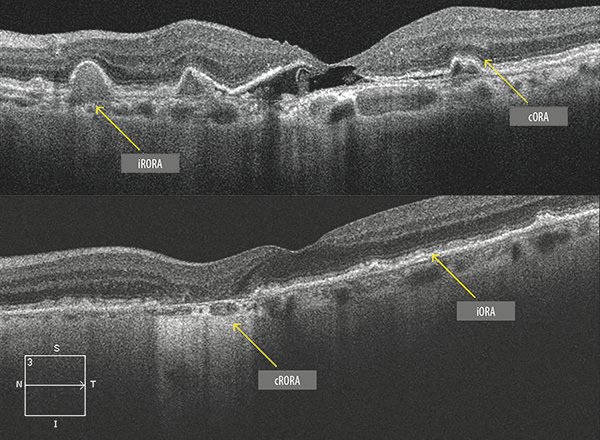
Figura 5. Formas atróficas de DMAE. El escaneo B del OCT ejemplifica las diferentes lesiones relacionadas con DMAE seca y atrofia geográfica.
cRORA
Atrofia completa del epitelio pigmentario de la retina (EPR) y la retina externa.
Se define como una zona de hipertransmisión homogénea y ausencia del EPR que mida al menos 250 micras con adelgazamiento de la retina externa suprayacente y pérdida de fotorreceptores. Los criterios de inclusión consisten en:
La presencia de una región de hipertransmisión homogénea de al menos 250 micras de diámetros en cualquier dimensión lateral.
Una zona de atenuación o disrupción del EPR de al menos 250 micras de diámetro.
Evidencia de degeneración de los fotorreceptores suprayacentes (pérdida de la zona de interdigitación, pérdida de la zona elipsoidal y adelgazamiento de la capa nuclear externa).
Los criterios de exclusión son la presencia de desplazamiento del EPR o de otros signos de rotura del EPR.
cORA
Atrofia completa de la retina externa. Se caracteriza por el adelgazamiento de la retina externa con disrupción de la MLE y la zona de interdigitación, pero con preservación del EPR. En este caso la hipertransmisión es intermitente.
iORA
Atrofia incompleta de la retina externa. En este caso hay adelgazamiento de la retina externa, pero la membrana limitante externa se encuentra indemne. Presenta disrupción de la zona elipsoidal. El EPR se encuentra intacto y no existe hipertransmisión.
Cabe aclarar que estos términos pueden usarse tanto en presencia como en ausencia de neovascularización. Las diferentes formas de atrofia se pueden ver combinadas en una misma línea de OCT.
DMAE neovascular
La DMAE neovascular se caracteriza por la aparición de neovasos en la retina, en el espacio subretinal o por debajo del epitelio pigmentario13. El crecimiento neovascular es considerado como una reacción de la retina a fenómenos isquémicos probablemente originados en la coroides. La localización anatómica de los neovasos se utiliza para clasificar los diferentes tipos de membranas (Fig. 6).
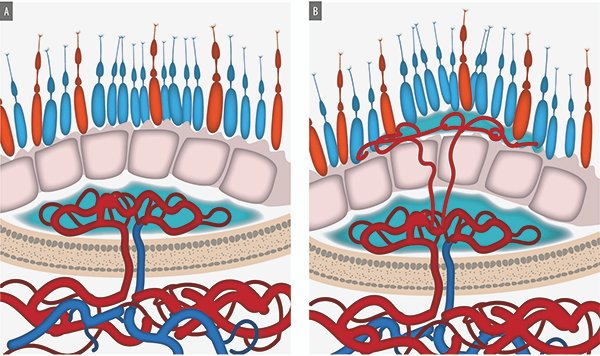
Figura 6. A) Esquema de membrana neovascular tipo I donde los neovasos están localizados por debajo del EPR. B) Los neovasos alcanzan el espacio subretinal por debajo del neuroepitelio (membrana neovascular tipo II).
Neovascularización macular tipo 1 (antiguamente “oculta”): por debajo del EPR
Consiste en áreas de complejos neovasculares que surgen desde la coroides y por OCT se observa como una elevación del EPR con material de hiperreflectividad heterogénea. Los neovasos provenientes del área coriocapilar se localizan por debajo del EPR produciendo generalmente un desprendimiento fibrovascular del epitelio pigmentario. Acompañando al crecimiento vascular aparecen fibroblastos, miofibroblastos y macrófagos que participan del desarrollo de la enfermedad y que pueden favorecer la formación de tejido fibroso14.
En la retinofluoresceinografía (RFG) estas lesiones muestran filtración en la región donde el EPR está elevado y esto se denominó neovascularización oculta (Fig. 7). La lesión hiperfluoresce desde tiempos tempranos observándose escape de medio de contraste en los tiempos tardíos. Por OCTA los neovasos se muestran por debajo del nivel del EPR.
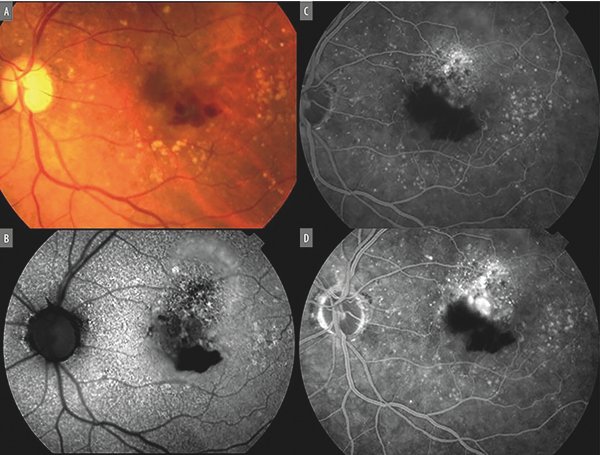
Figura 7. A) Múltiples drusen distribuidos de forma irregular en la región macular. La hemorragia subretinal hace sospechar la presencia de una membrana neovascular coroidea. B) Autofluorescencia macular revela alteración difusa del EPR. C) Fase temprana de la angiografía con fluoresceína donde se observa hiperfluorescencia por encima del área de bloqueo que produce la hemorragia. D) Tiempos tardíos de la misma angiografía donde se observan escape de medio de contraste de origen indeterminado (membrana neovascular coroidea oculta).
Neovascularización tipo 1 aneurismática (vasculopatía polipoide)
Este es un subtipo importante de neovascularización coroidea tipo 1, ya que en muchos casos presenta elementos dilatados en el borde externo de la lesión. Esto se debe a la presencia de una red vascular ramificada y de nódulos vasculares denominados inicialmente como pólipos (Fig. 8)15.

Figura 8. Diferentes fases de la angiografía con fluoresceína de un paciente con dilataciones aneurismáticas (tiempos tempranos) por debajo del EPR, asociada a exudación en los tiempos tardíos (membrana neovascular polipoide o dilatación aneurismática tipo I).
No es muy frecuente en la raza blanca pero representa casi el 50% de los pacientes con forma exudativa de DMAE en la raza asiática. Mientras que en esta etnia los hombres son más afectados, lo opuesto sucede en pacientes de raza blanca. La red vascular sub-RPE puede ser extensa. En el borde externo de la lesión vascular los elementos nodulares pueden tener la apariencia de dilataciones aneurismáticas.
Las lesiones vasculares se ponen en evidencia con indocianina verde y OCTA16. El verde de indocianina (ICG) puede ayudar a delimitar la lesión, revela la red ramificada y la presencia de los pólipos o nódulos vasculares localizados por debajo de la cara posterior del desprendimiento del EPR. Se expande lentamente en el espacio subepitelio pigmentario y puede adquirir un tamaño considerable antes de tener impacto en la visión. Habitualmente muestra filtración en tiempos tardíos en forma de placa o puntos calientes (Fig. 9).
Adicionalmente, la angiografía por OCT (OCTA) puede ayudar a visualizar mejor estas lesiones (Fig. 10). En un alto porcentaje de casos las dilataciones aneurismáticas pueden no ser visibles y presentar un flujo lento que no son detectados por este método. El escaneo con OCT en la región macular suele ser útil al demostrar la presencia de desprendimientos múltiples del EPR. Las lesiones nodulares también pueden ser visibles con esta técnica, donde es característico el signo de la doble línea (separación de las líneas hiperreflectivas correspondiente al EPR y la membrana de Bruch) y los desprendimientos múltiples del epitelio pigmentario. Algunos de ellos pueden tener el formato en “dedo de guante”17.
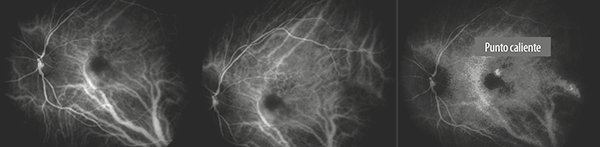
Figura 9. Verde de indocianina de la misma paciente de la figura 5. En el extremo de la derecha se observa “punto caliente” superior y temporal a la fóvea. Ejemplo de membrana neovascular de localización extrafoveal.
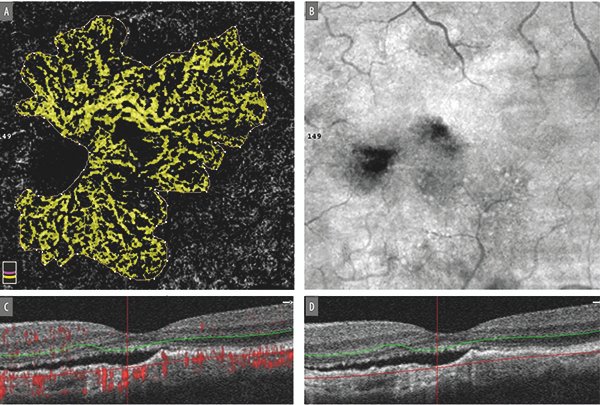
Figura 10. A) Ejemplo de membrana neovascular coroidea tipo I subfoveal mostrada por OCTA. B) “enFace” OCT donde se observa alteración difusa del EPR. C y D) La línea horizontal y vertical del OCT muestra desprendimiento del neuroepitelio secundario debido al fluido proveniente de los neovasos que se encuentran por debajo del EPR.
Recientemente se ha propuesto un cambio en la nomenclatura. Teniendo en cuenta que un pólipo es un crecimiento de tejido sólido a partir de una membrana mucosa no sería correcto aplicar el término para describir una lesión vascular. Por este motivo la nueva denominación propone el nombre de lesiones aneurismáticas tipo 1.
Tanto la filtración como las hemorragias o el tejido fibroso pueden favorecer la expansión del desprendimiento fibrovascular. La presencia de fluido intrarretinal puede aparecer de forma secundaria a la rotura de la membrana limitante externa. En la angiografía fluoresceínica se observa un patrón granular hiperfluorescente sobre el área del desprendimiento del epitelio pigmentario que se va expandiendo para coalescer en las fases tardías de la angiografía.
Neovascularización macular tipo 2 (antes “clásica”): por encima del EPR
El complejo neovascular está en el espacio subretinal por encima del nivel del epitelio pigmentario (los neovasos atraviesan el EPR y ganan acceso al espacio subretinal) y puede asociarse a material hiperreflectivo subretinal con o sin desprendimiento del neuroepitelio. En el OCT se observa la membrana por encima del epitelio pigmentario. En la angiografía fluoresceínica el patrón de lesión clásica (angiográficamente) se puede reconocer toda la superficie y los límites de la membrana desde los tiempos tempranos, generalmente rodeada por un halo hipo fluorescente. En la OCTA se puede demostrar el complejo neovascular por encima del epitelio pigmentario.
Neovascularización macular tipo 3 (antes “proliferación angiomatosa retinal”)
Mediante el OCT se observa hiperreflectividad que se extiende desde la retina media hasta el nivel del EPR asociado a edema intrarretinal, hemorragias y vasos telangiectásicos. A diferencia de las formas anteriores, los neovasos se originan a partir de los plexos capilares de la retina; secundariamente invaden el espacio subretinal y atraviesan el EPR. La proliferación vascular se sospecha que se origina en el plexo capilar profundo con un vector de crecimiento hacia la retina externa. El incremento de flujo en la proliferación angiomatosa es provisto por los vasos retinales que se adaptan a las nuevas condiciones circulatorias (Fig. 11). En el fondo del ojo se pueden ver pequeñas hemorragias retinales y espacios quísticos. Su localización inicial suele ser extrafoveal.
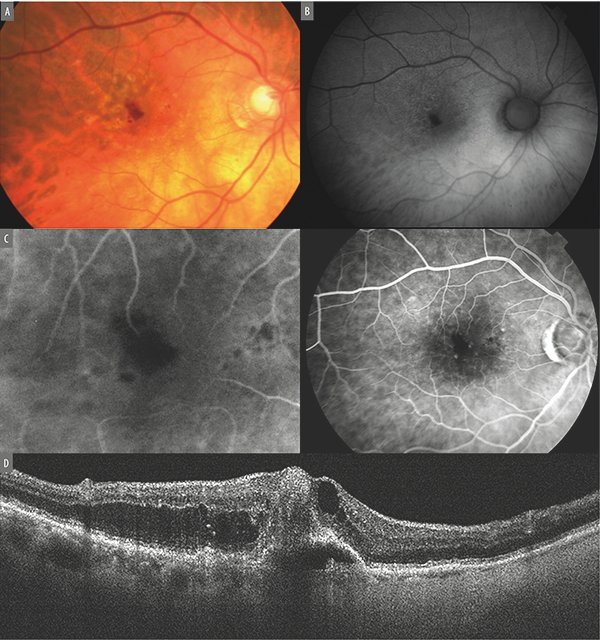
Figura 11. Proliferación angiomatosa de la retina (neovascularización tipo III). A) Sutil hemorragia superficial extrafoveal asociada a la presencia de drusas reticulares. B) Autofluorescencia macular donde además de la hemorragia los drusen son hipoautofluorescentes en el centro mientras que se observa rodeados de una circina hiperautofluorescencia. C) Angiografía con fluoresceína muestra los vasos eferentes y aferentes asociados a la hemorragia. D) OCT revela la presencia de complejo neovascular intrarretinal asociado a un desprendimiento fibrovascular del EPR.
Suelen ser lesiones muy activas debido al alto flujo que le provee la circulación retinal.
En el OCTA inicialmente puede presentar foco hiperintenso a nivel del plexo capilar profundo; con el tiempo muestra el crecimiento descendente de nuevos vasos anómalos hacia el EPR e incluso pueden penetrar el nivel del EPR18.
Membrana neovascular coroidea mixta (tipo 1 y 2 combinadas)
En este caso el OCT detecta componentes de la MNV tipo 1 y 2 en conjunto. Del mismo modo que por OCTA los neovasos se localizan tanto en el espacio subretinal como en el espacio sub-EPR. En la clasificación angiográfica se corresponde con la MNV mínimamente clásica, se manifiesta hiperfluorescencia en las fases tempranas con filtración tardía, rodeada por hiperfluorescencia granular que también filtra en los tiempos tardíos. Puede ser difícil de diferenciar de una MNV tipo 3.
Anastomosis retinocoroideas
Esta circunstancia ocurre cuando existe una comunicación directa entre los vasos retinales y los coroideos. Generalmente son más evidentes en casos crónicos.
Manifestaciones clínicas relacionadas con la enfermedad neovascular
Exudación activa
Se refiere al escape de fluido a partir de la presencia de neovasos. El líquido puede localizarse en uno de tres compartimentos:
por debajo del EPR constituyendo un desprendimiento fibrovascular del mismo.
por debajo del neuroepitelio (fluido subretinal).
en forma de quistes en el interior de la retina (Fig. 12)19.
La manifestación angiográfica es la hiperfluorescencia con escape de medio de contraste en tiempos tardíos. El colorante se puede acumular en los tejidos o en los espacios quísticos en el interior de los mismos.

Figura 12. Ejemplos de los tres compartimentos que pueden ser ocupados por la presencia de fluidos provenientes de una membrana neovascular coroidea (intra o subretinal o por debajo del EPR).
Fluido intra y subretinal
Aparecen cuando el EPR no es capaz de remover el líquido producido por la membrana. El fluido intrarretinal puede provenir de los mismos vasos retinales o por difusión de la retina debido a anormalidades de la membrana limitante externa20.
La acumulación de fluido subretinal depende de las alteraciones de la función de bomba del epitelio pigmentario.
Lípidos o exudados duros
Acumulación de lípidos en el interior de los tejidos retinales. Generalmente están asociados a la presencia de exudación activa (Fig. 13)14.

Figura 13. A) En ojo derecho se observa abundante cantidad de exudados duros rodeando una lesión vascular en ovillo que corresponde a una proliferación angiomatosa de la retina. B) Autofluorescencia macular que muestra alteración difusa del EPR en la región macular de ambos ojos.
Material hiperreflectivo subretinal (autofluorescencia)
Lesión de composición aún indeterminada revelada por el OCT por encima del EPR. El material hiperreflectivo puede incluir la presencia de fluido, fibrina y células inflamatorias (Fig. 14). En la autofluorescencia macular (FAF) no hiperautofluoresce21. Esta característica lo diferencia del material viteliforme. Suele modificarse con el paso del tiempo, modulado por la terapia antiangiogénica y modificando las características de sus bordes. En general se asocia a mal pronóstico visual debido a que con el tiempo es reemplazado por tejido fibroso. Su presencia significa actividad neovascular.

Figura 14. A) Scan B del OCT que muestra material hiperreflectivo subretinal asociado a un doble desprendimiento del EPR. También se observa exudación lipídica. B) En lesión de menor tiempo de evolución se observa el material hiperreflectivo subretinal igualmente asociado a un DEP.
Desprendimiento del epitelio pigmentario de la retina
Ocurre cuando la presencia de fluido, sangre, material drusenoide y/o tejido neovascular eleva el EPR por encima de la membrana de Bruch (Fig. 15)19. Cuando predomina el componente seroso se debe sospechar la presencia de una membrana neovascular. En este último caso suele tener un borde irregular. En la angiografía con fluoresceína es característica una muesca que indica la localización de la neovascularización. La OCT y la OCTA pueden ayudar a definir su composición revelando la presencia de tejido neovascular.
Hemorragias
Se originan por rotura de los vasos que forman el complejo neovascular (Fig. 15) o desde la coroides cuando ocurre un desgarro del EPR. El componente hemático de la lesión puede localizarse por debajo del EPR formando una lesión que se conoce con el nombre de DEP hemorrágico9. Otra localización frecuente es la subretinal por debajo del neuroepitelio. Puede también ocupar espacios quísticos en el interior de la retina. Por último, cuando el sangrado es masivo, también puede presentarse en forma de hemorragia vítrea.

Figura 15. Ejemplos de los diferentes tipos de desprendimientos del EPR.
Fibrosis
Las lesiones crónicas suelen ir aumentando el componente colágeno que las conforma. La fibrosis es parte del proceso de cicatrización que resulta de la acción de numerosas citoquinas y de factores humorales que la estimulan. Su presencia suele ser de mal pronóstico ya que se asocia a lesiones crónicas con marcada alteración de la retina externa y de los fotorreceptores13.
Rotura o desgarro del EPR
Suele producirse un desprendimiento del epitelio pigmentario de la retina (DEP) fibrovascular donde los de mayor altura tendrían un riesgo incrementado y en ocasiones ocurre relacionada con la inyección de agentes antiangiogénicos6. La contracción brusca del tejido fibroso en el interior del DEP puede romper uno de los extremos ocasionando esta complicación que suele asociarse a una pérdida brusca e indolora de la visión6. Es frecuente ver un componente hemorrágico asociado donde los bordes del EPR suelen enrollarse sobre sí mismos como ocurre con el extremo de un pergamino6. Suelen ser visibles tanto en la foto color como en la autofluorescencia macular. La RFG revela la falta de EPR mostrando directamente detalles de la circulación coroidea.
REFERENCIAS
1. Aronow ME, Chew EY. Age-Related Eye Disease Study 2: perspectives, recommendations, and unanswered questions. Curr Opin Ophthalmol 2014; 25: 186-190. doi:10.1097/ICU.0000000000000046.
2. Ferris FL, Davis MD, Clemons TEet al. A simplified severity scale for age-related macular degeneration: AREDS Report No. 18. Arch Ophthalmol 2005; 123: 1570-1574. doi:10.1001/archopht.123.11.1570
3. Vitale S, Agrón E, Clemons TE et al. Association of 2-year progression along the AREDS AMD scale and development of late ager-related macular degeneration or loss of visual acuity: AREDS Report 41. JAMA Ophthalmol 2020; 138: 610-617. doi:10.1001/jamaophthalmol.2020.0824 [corrección en JAMA Ophthalmol 2020; 138: 804].
4. de Jong PT. Age-related macular degeneration. N Engl J Med 2006; 355: 1474-1485. doi:10.1056/NEJMra062326.
5. Chakravarthy U, Evans J, Rosenfeld PJ. Age related macular degeneration. BMJ 2010; 340: c981. doi:10.1136/bmj.c981.
6. Fleckenstein M, Mitchell P, Freund KB et al. The progression of geographic atrophy secondary to age-related macular degeneration. Ophthalmology 2018; 125: 369-390. doi:10.1016/j.ophtha.2017.08.038.
7. Yasukawa T, Mori R, Sawa M et al. Fundus autofluorescence and retinal sensitivity in fellow eyes of age-related macular degeneration in Japan. PLoS One 2019; 14: e0213161. doi:10.1371/journal.pone.0213161.
8. Farinha C, Cachulo ML, Coimbra Ret al. Age-related macular degeneration staging by color fundus photography vs. multimodal imaging-epidemiological implications (The Coimbra Eye Study-Report 6). J Clin Med 2020; 9: 1329. doi:10.3390/jcm9051329.
9. Singh SR, Lupidi M, Mishra SB et al. Unique optical coherence tomographic features in age-related macular degeneration. Surv Ophthalmol 2020; 65: 451-457. doi:10.1016/j.survophthal.2020.01.001.
10. Sadda SR, Guymer R, Holz FGet al. Consensus definition for atrophy associated with age-related macular degeneration on OCT: Classification of Atrophy Report 3 Ophthalmology 2018; 125: 537-548. doi:10.1016/j.ophtha.2017.09.028 [corrección en Ophthalmology 2019; 126: 177].
11. Folgar FA, Jaffe GJ, Ying GS et al. Comparison of Age-Related Macular Degeneration Treatments Trials Research Group. Comparison of optical coherence tomography assessments in the comparison of age-related macular degeneration treatments trials. Ophthalmology 2014; 121: 1956-1965. doi:10.1016/j.ophtha.2014.04.020.
12. Guymer RH, Rosenfeld PJ, Curcio CA et al. Incomplete retinal pigment epithelial and outer retinal atrophy in age-related macular degeneration: Classification of Atrophy Meeting Report 4. Ophthalmology 2020; 127: 394-409. doi:10.1016/j.ophtha.2019.09.035.
13. Perrott-Reynolds R, Cann R, Cronbach N et al. The diagnostic accuracy of OCT angiography in naive and treated neovascular age-related macular degeneration: a review. Eye (Lond) 2019; 33: 274-282. doi:10.1038/s41433-018-0229-6.
14. Arrigo A, Aragona E, Di Nunzio C et al. Quantitative optical coherence tomography angiography parameters in type 1 macular neovascularization secondary to age-related macular degeneration. Transl Vis Sci Technol 2020; 9: 48. doi:10.1167/tvst.9.9.48.
15. Chaikitmongkol V, Cheung CMG, Koizumi H et al. Latest developments in polypoidal choroidal vasculopathy: epidemiology, etiology, diagnosis, and treatment. Asia Pac J Ophthalmol (Phila) 2020; 9: 260-268. doi:10.1097/01.APO.0000656992.00746.48.
16. De Carlo TE, Romano A, Waheed NK, Duker JS. A review of optical coherence tomography angiography (OCTA). Int J Retina Vitreous 2015; 1: 5. doi:10.1186/s40942-015-0005-8.
17. Kashani AH, Chen CL, Gahm JK et al. Optical coherence tomography angiography: a comprehensive review of current methods and clinical applications. Prog Retin Eye Res 2017; 60: 66-100. doi:10.1016/j.preteyeres.2017.07.002.
18. Tsai ASH, Cheung N, Gan ATL et al. Retinal angiomatous proliferation. Surv Ophthalmol 2017; 62: 462-492. doi:10.1016/j.survophthal.2017.01.008.
19. Karampelas M, Malamos P, Petrou P et al. Retinal pigment epithelial detachment in age-related macular degeneration. Ophthalmol Ther 2020; 9: 739-756. doi:10.1007/s40123-020-00291-5.
20. Schmidt-Erfurth U, Klimscha S, Waldstein SM, Bogunović H. A view of the current and future role of optical coherence tomography in the management of age-related macular degeneration. Eye (Lond) 2017; 31: 26-44. doi:10.1038/eye.2016.227.
21. Leung KFC, Downes SM, Chong V. A Retrospective analysis of the effect of subretinal hyper-reflective material and other morphological features of neovascular age-related macular degeneration on visual acuity outcomes in eyes treated with intravitreal aflibercept over one year. Vision (Basel) 2018; 2: 5. doi:10.3390/vision2010005.














